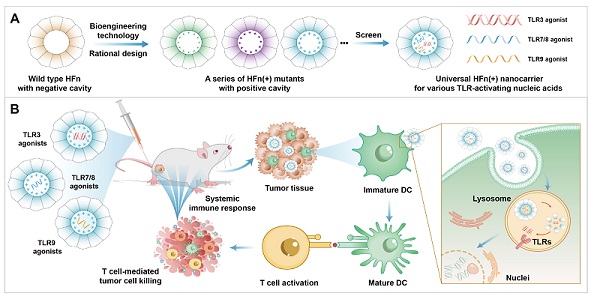
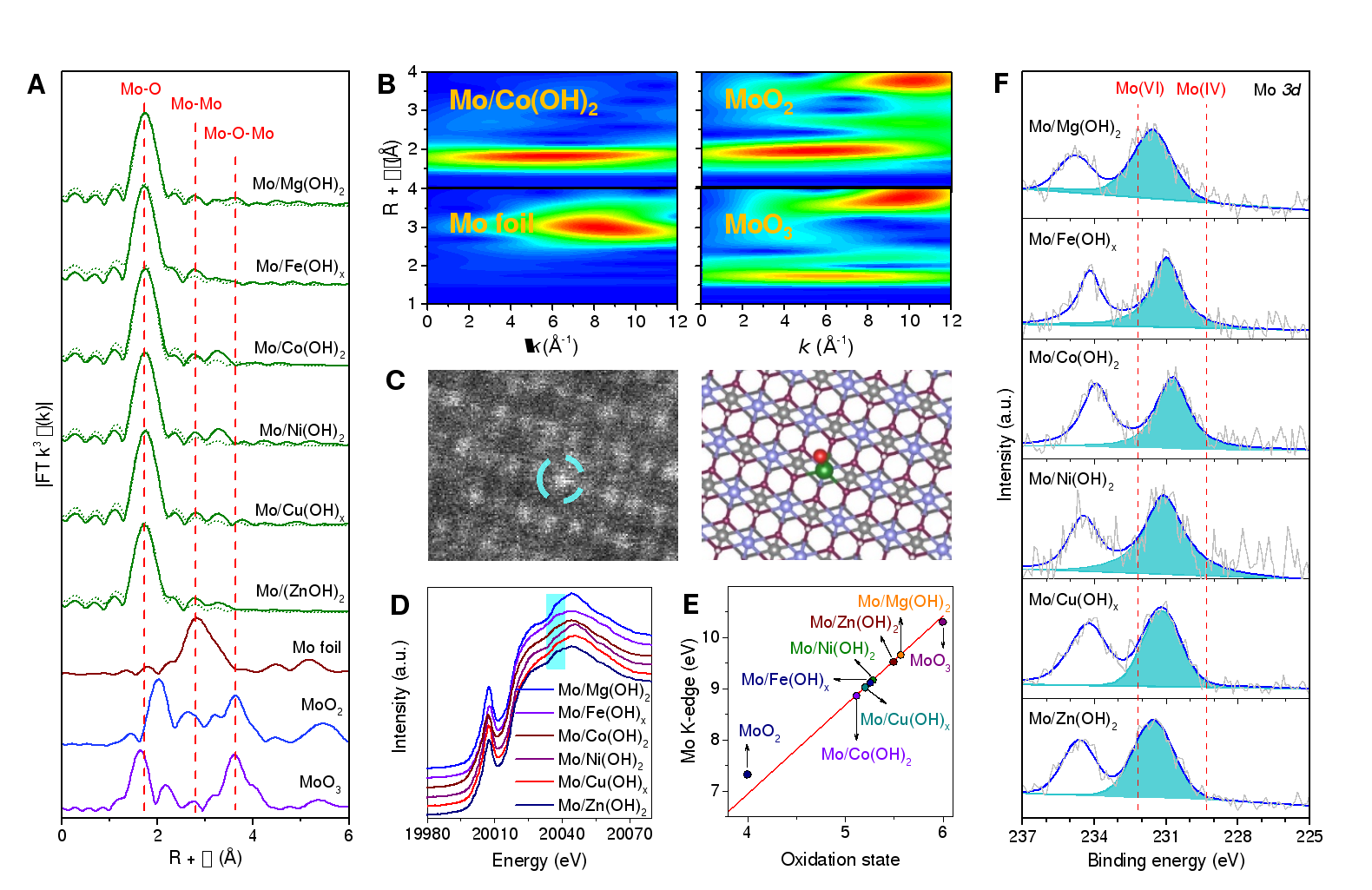
蔡理慧Cell Stem Cell发文:小胶质细胞如何导致阿尔茨海默病
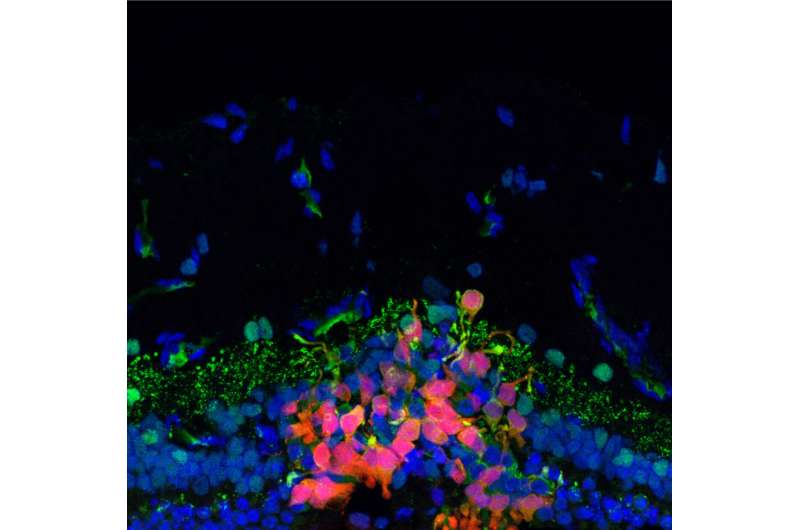
图片:麻省理工学院的研究人员通过诱导多能干细胞生成表达ApOE3基因的神经元。图中神经元的树突被染成青色。
阿尔茨海默病的一个特征是大脑中某些神经元的放电减少,这导致了患者的认知能力下降。麻省理工学院的一项新研究显示了一种名为小胶质细胞的细胞是如何导致神经元活动放缓的。
研究发现,表达ApOE4基因的小胶质细胞不能正常代谢脂质,ApOE4基因是阿尔茨海默病的最强遗传风险因素之一。这会导致过多的脂质积聚,干扰附近神经元相互交流的能力。
“ApOE4是一种主要的遗传风险因素,许多人携带它,所以希望通过研究ApOE4,也将提供阿尔茨海默病的基本病理生理学的更大的图片,以及什么基本的细胞过程出错导致了阿尔茨海默病,”麻省理工学院皮考尔学习与记忆研究所主任,该研究的资深作者Li-Huei Tsai说。
这一发现表明,如果研究人员能够找到一种恢复小胶质细胞正常脂质代谢的方法,这可能有助于治疗该疾病的一些症状。
麻省理工学院博士后Matheus Victor是这篇论文的主要作者。
脂质过载
大约14%的人携带ApOE4基因变体,这使它成为与晚发性、非家族性阿尔茨海默病有关的最常见的基因变体。携带一个ApOE4基因副本的人患阿尔茨海默病的风险增加三倍,携带两个ApOE4基因副本的人患阿尔茨海默病的风险增加十倍。
“如果你从另一个角度看这个问题,如果你看整个老年痴呆症人群,大约50%的人是ApOE4携带者。所以,这是一个非常重大的风险,但我们仍然不知道为什么ApOE4等位基因会有这样的风险,”Tsai说。
ApOE基因还有另外两种形式,一种是ApOE2,被认为能预防阿尔茨海默病,另一种是最常见的ApOE3,被认为是中性的。ApOE3和ApOE4只差一个氨基酸。
几年来,Tsai教授的实验室一直在研究ApOE4对大脑中各种类型细胞的影响。为了做到这一点,研究人员使用了来自人类捐赠者的诱导多能干细胞,并将它们改造成表达ApOE基因的特定版本。这些细胞可以被刺激分化为脑细胞,包括神经元、小胶质细胞和星形胶质细胞。
在2018年的一项研究中,他们表明ApOE4导致神经元产生大量淀粉样β肽42,这是一种与阿尔茨海默病相关的分子,会导致神经元过度活跃。该研究发现,ApOE4还影响小胶质细胞和星形胶质细胞的功能,导致胆固醇积累、炎症和清除淀粉样β肽的失败。
2021年的一项后续研究表明,ApOE4星形胶质细胞处理各种脂质的能力严重受损,导致甘油三酯和胆固醇等分子的堆积。在那篇论文中,研究人员还表明,用胆碱处理表达ApOE4的工程酵母细胞,胆碱是一种膳食补充剂,是磷脂的组成部分,可以逆转ApOE4的许多有害影响。
在他们的新研究中,研究人员想调查ApOE4如何影响小胶质细胞和神经元之间的相互作用。最近的研究表明,小胶质细胞在调节神经元活动中发挥重要作用,包括它们在神经系统内的交流能力。小胶质细胞还会在大脑中寻找受损或病原体的迹象,并清除碎片。
研究人员发现,ApOE4破坏了小胶质细胞代谢脂质的能力,并阻止它们从环境中清除脂质。这会导致环境中脂肪分子,尤其是胆固醇的堆积。这些脂肪分子与嵌在神经元细胞膜上的特定类型的钾通道结合,从而抑制神经元放电。
“我们知道,在阿尔茨海默病的晚期,神经元的兴奋性会降低,所以我们可能会用这个模型来模拟这种情况,”维克多说。
研究人员发现,小胶质细胞中脂质的积聚也会导致炎症,而这种类型的炎症被认为是导致阿尔茨海默病进展的原因。
恢复功能
研究人员还表明,他们可以通过使用一种名为Triacsin C的药物治疗ApOE4小胶质细胞来逆转脂质超载的影响,这种药物会干扰脂滴的形成。当ApOE4小胶质细胞接触这种药物时,研究人员发现小胶质细胞和邻近神经元之间的正常通信被恢复。
“我们可以通过ApOE4小胶质细胞恢复对神经元活动的抑制,可能是通过脂质稳态的恢复,此时脂肪酸不会在细胞外积聚。”
Triacsin C对细胞有毒性,所以它可能不适合用作治疗阿尔茨海默病的药物,但研究人员希望其他恢复脂质稳态的方法可以帮助对抗疾病。在她2021年的ApOE4研究中,她表明胆碱也有助于恢复正常的小胶质细胞活动。
“脂质稳态实际上对阿尔茨海默氏症大脑中的许多细胞类型至关重要,所以这不是一个小胶质细胞的问题。”“问题是,如何在多种细胞类型中恢复脂质稳态?这不是一个简单的任务,但我们正在通过胆碱来解决这个问题,这可能是一个非常有趣的角度。”
研究人员现在正在进一步研究小胶质细胞如何从健康状态转变为“脂质负荷”的炎症状态,希望找到阻止这一转变的方法。在之前对小鼠的研究中,他们已经表明,暴露在以特定频率闪烁的LED光下,可以帮助小胶质细胞恢复活力,刺激细胞恢复正常功能。
文章标题Lipid Accumulation Induced by ApOE4 Impairs Microglial Surveillance of Neuronal-Network Activity