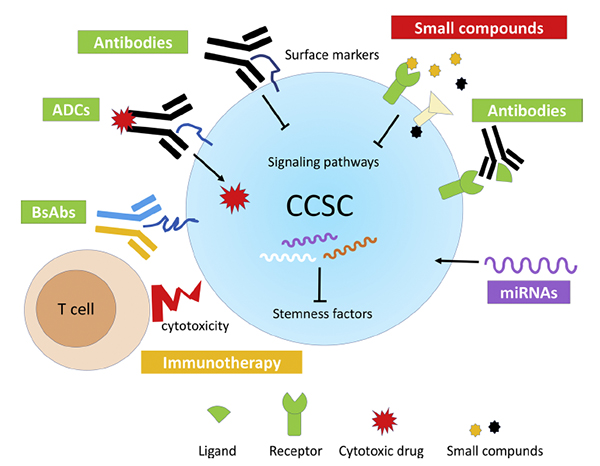
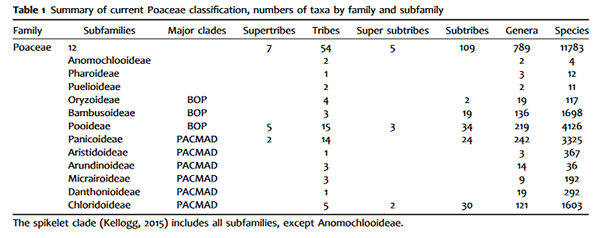
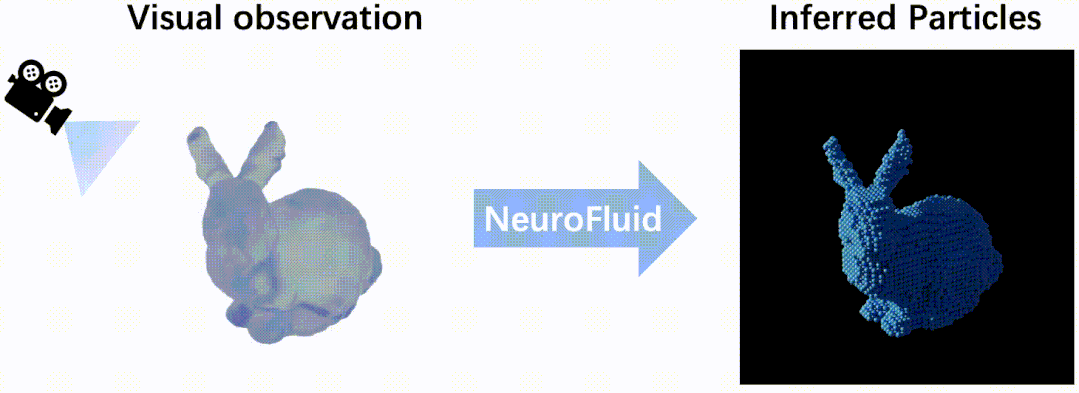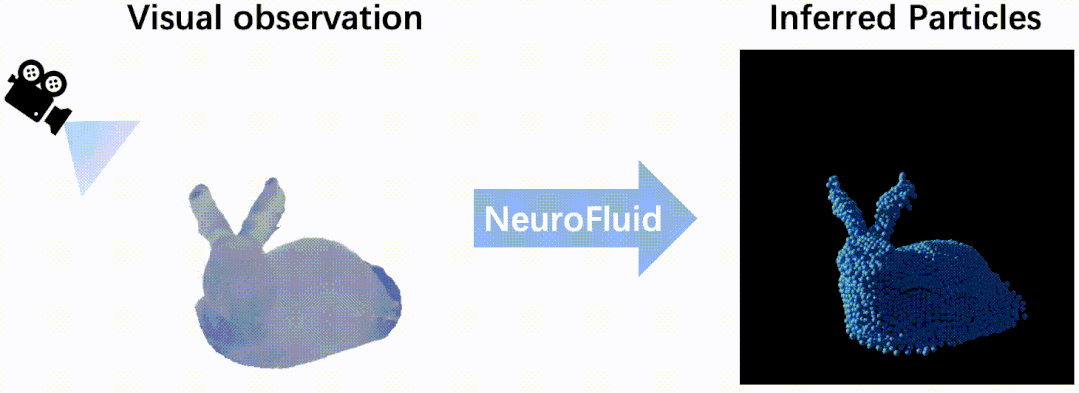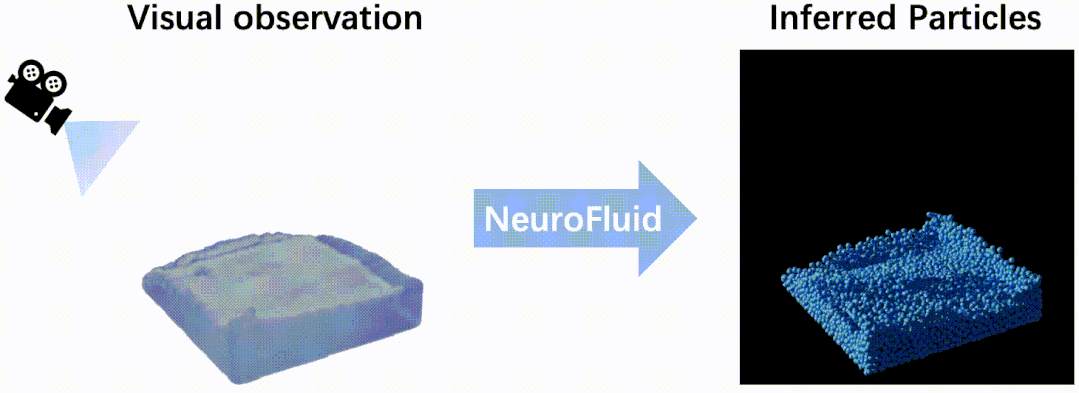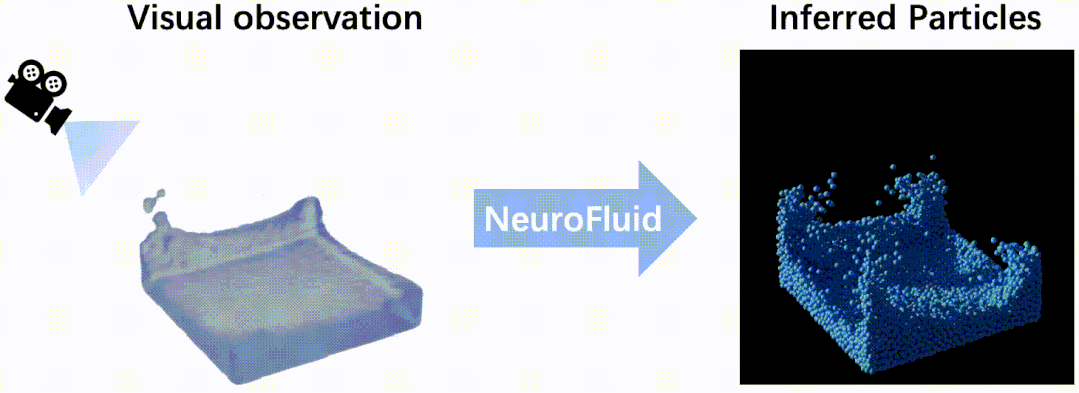
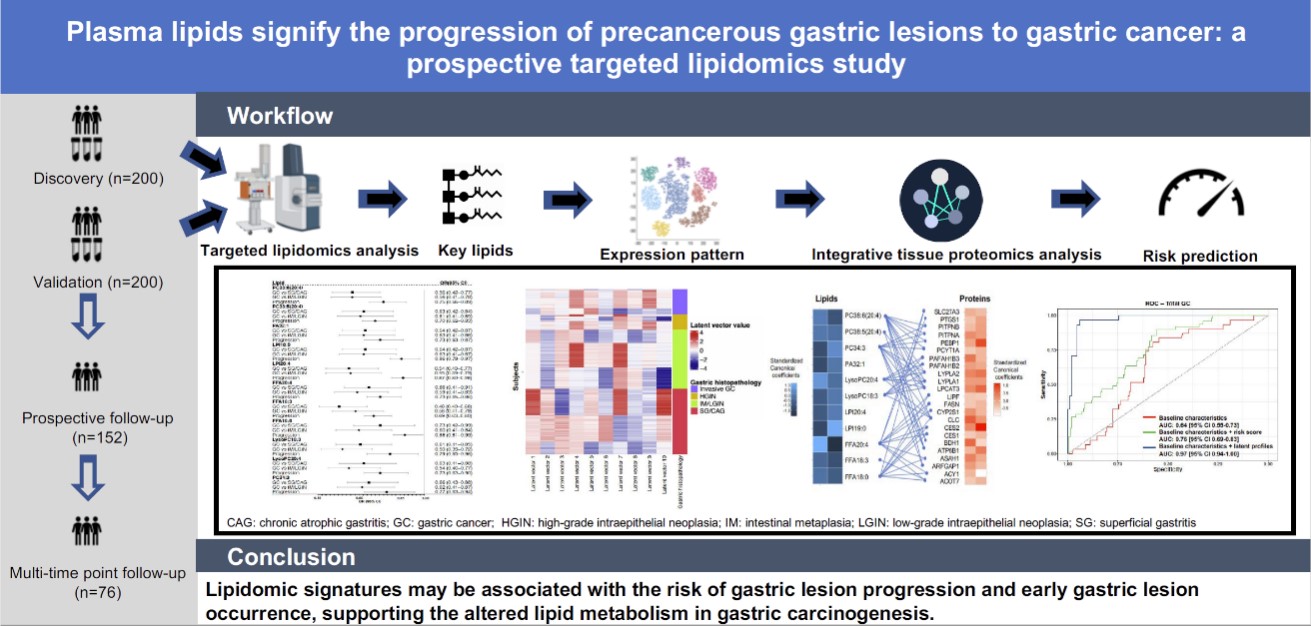
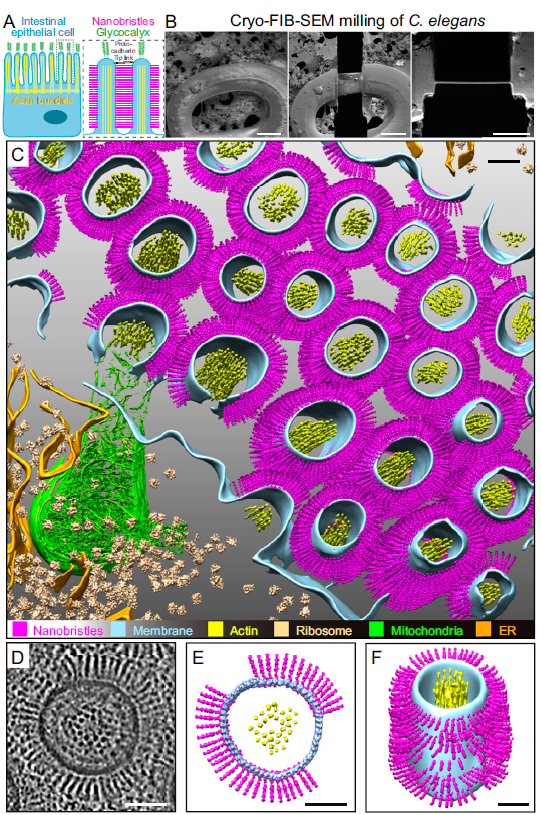
浙江大学浙大药学院高建青和韩旻团队在Nature Communications报道响应...
2022年5月25日,浙江大学药学院高建青教授、韩旻副教授团队通过构建体内响应性后组装“多肽纳米毯”在肿瘤转移的防治方面提出新策略,在Nature Communications在线发表了题为“peptide nano-blanket impedes fibroblasts activation and subsequent formation of pre-metastatic niche”的研究论文。

在循环肿瘤细胞真正抵达并定植于潜在转移风险的远端脏器组织之前,原位肿瘤分泌肿瘤相关分泌因子(TDSF)诱导转移前微环境的发展形成。转移前微环境对于肿瘤转移的发生发展至关重要,假若能阻止转移前微环境的形成,是否就能够做到“釜底抽薪”,控制甚至预防肿瘤转移的发生?
研究团队在成功构建肿瘤转移前微环境动物模型的基础上,记录了在肺转移前微环境发展过程中,基质微环境和免疫微环境两大方面的动态病理进程,主要包括:成纤维细胞激活、胞外基质成分沉积、血管新生及通透性提高、骨髓来源的免疫抑制性细胞(MDSC)募集并发挥免疫抑制性功能等。
基于转移前微环境的病理特征,研究团队设计构建了转移前微环境响应性后组装多肽分子FR17,并通过多种技术手段考察了该多肽分子在转移前微环境定点后组装形成的薄膜毯状纳米结构—作者将其命名为“多肽纳米毯”。
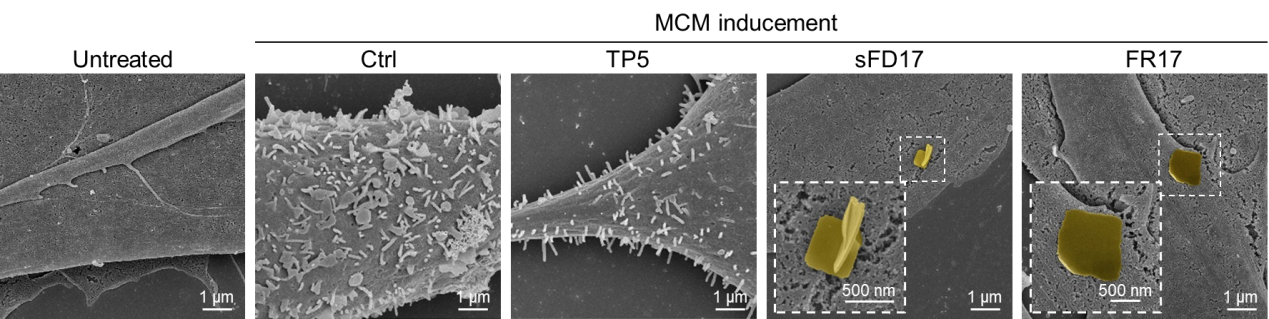
图1. 多肽FR17在肿瘤上清液刺激后响应性自组装形成“多肽纳米毯”,抑制成纤维细胞的激活
机制研究揭示了响应性后组装形成的“多肽纳米毯”通过抑制转移前微环境早期形成过程中成纤维细胞的激活,抑制促转移基质微环境的发展形成;遏止基质重塑、血管新生和渗漏过程;抑制MDSC迁移趋化,降低了MDSC的募集比例,改善了免疫抑制性微环境。
在黑色素瘤肺转移模型以及原位肿瘤切除术后复发和转移模型中,多肽FR17均表现出良好的抗转移效果。研究结果证明,响应性后组装“多肽纳米毯”通过对转移前微环境发展形成过程的干预,能够有效降低肿瘤转移风险。

图2.论文示意图:“多肽纳米毯”通过抑制成纤维细胞的激活,遏制转移前微环境的发展形成
该研究设计构建了转移前微环境响应性后组装多肽FR17,并证明FR17在体后组装形成的“多肽纳米毯”通过抑制成纤维细胞激活调控转移前微环境的形成,实现了肿瘤转移的有效防治,为抗肿瘤转移多肽药物递送提供了一种自身具有微环境调控能力的响应性后组装功能性载体平台。
该研究论文的第一作者为浙江大学药学院博士生周熠,通讯作者为浙江大学药学院高建青教授和韩旻副教授。
原文链接:
https://www.nature.com/articles/s41467-022-30634-8.