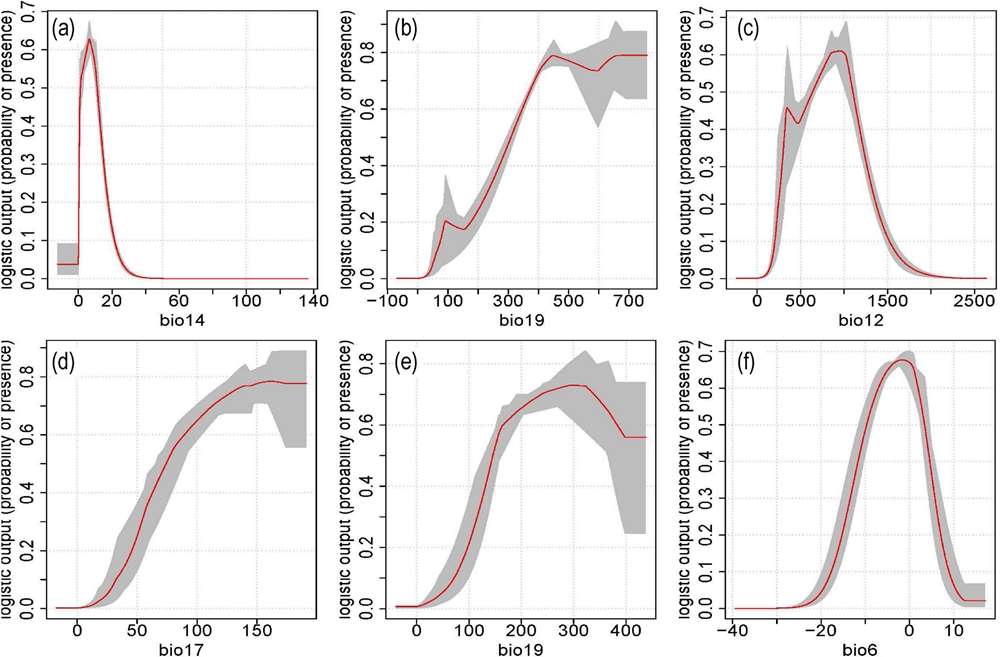
去泛素化酶OTUD6A通过增加TopBP1稳定性调控肿瘤细胞耐药和乳腺癌发展
近日,Cell Death and Differentiation期刊在线发表了北京大学生命科学学院及蛋白质与植物基因研究国家重点实验室郑晓峰教授研究组的题为“Deubiquitinase OTUD6A promotes breast cancer progression by increasing TopBp1 stability and rendering tumor cellsresistant to DNA-damaging therapy”的研究文章。该研究发现OTUD6A通过调控TopBp1蛋白的泛素化修饰和稳定性来参与DNA损伤修复,维持细胞基因组稳定性,抑制肿瘤细胞对放化疗药物的敏感性并促进乳腺癌的发展。揭示了去泛素化酶OTUD6A参与DNA损伤应答及调控肿瘤细胞耐药的分子机制。
针对多种内外因素刺激诱导产生的DNA损伤,正确而及时的修复对维持细胞基因组的稳定性至关重要,损伤的累积会引起基因突变甚至会诱发肿瘤的发生。泛素化/去泛素化和磷酸化等蛋白质翻译后修饰在DNA损伤应答中,通过调控关键损伤修复蛋白的稳定性和亚细胞定位等发挥着精细的调控作用。TopBp1在调控细胞周期检验点控制、复制叉阻滞及DNA损伤修复过程中发挥重要作用。TopBp1在乳腺癌等多种肿瘤细胞中高表达,其与肿瘤患者差的预后相关,其功能受到包括磷酸化修饰、甲基化修饰、乙酰化修饰等翻译后修饰的调控,但调控TopBp1蛋白水平的去泛素化酶及其作用机制还有待研究。
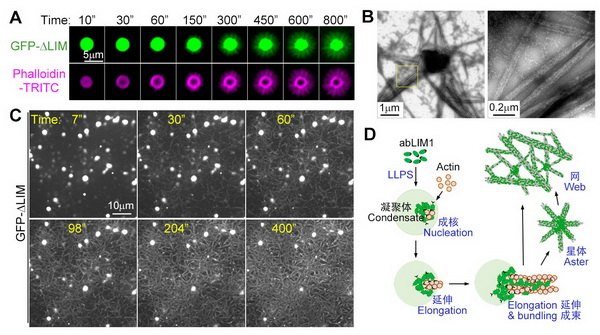
该研究发现,去泛素化酶OTUD6A在乳腺癌病人组织中高表达,它参与DNA损伤应答并在维持基因组稳定性中具有重要调控作用。在应答DNA损伤时,磷酸酶pp2A通过去除OTUD6A第70、71和74位点上丝氨酸的磷酸化修饰促进OTUD6A进入细胞核并被招募到染色质上。OTUD6A通过抑制TopBp1与其泛素E3连接酶UBR5的相互作用来抑制TopBp1的K48连接的多聚泛素化修饰来增强TopBp1的稳定性,进而促进CHK1磷酸化激活,以依赖TopBp1的方式促进乳腺癌细胞的增殖和迁移。进一步研究发现,OTUD6A 的敲低使细胞阻滞在S期,导致CHK1激活受阻并使基因组不稳定性提高,使得肿瘤细胞对化疗药物更加敏感。裸鼠成瘤实验也表明OTUD6A的敲低通过负调控TopBp1蛋白水平抑制乳腺癌肿瘤的生长。与野生型对照小鼠相比,otud6-/-小鼠对IR 照射明显更加敏感,otud6-/-MEF细胞也表现出基因组不稳定性。
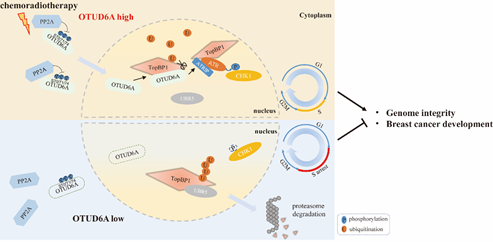
OTUD6A调控DNA损伤修复模式图
郑晓峰课题组的博士研究生赵燕为文章的第一作者,郑晓峰为文章的通讯作者。北大生科院博士生黄新平、朱丹、卫敏、罗杰琛和于书玉也在该课题中作出了重要贡献。该研究得到了国家自然科学基金重点项目、蛋白质与植物基因研究国家重点实验室、生命科学学院、生命科学学院仪器中心以及凤凰平台的大力支持。