清华大学生命学院郗乔然课题组揭示DNA修复相关蛋白HMCES在小鼠胚胎干细胞中的转录调…
胚胎干细胞具有自我更新和多向分化的潜能,理论上可以分化成组织内的各种细胞类型,是再生医学的重要细胞来源。解析胚胎干细胞分化发育的内在机理对于再生医学的应用具有重大理论意义。TGF-β家族信号通路(包括TGF-β/activin/nodal信号、BMp信号通路等)对于干细胞的干性状态维持、分化方向的决定具有不可或缺的调控功能。TGF-β家族信号的细胞环境依赖性功能很大程度上依赖于R-SMAD蛋白的转录调节。激活的R-SMAD转录因子通过与其他转录因子、表观遗传修饰蛋白、长链非编码RNA等的动态结合或拮抗,从而影响靶基因启动子区域的染色质开放程度、表观遗传修饰特征等,进而调控靶基因的转录表达水平。目前,针对TGF-β家族信号通路在干细胞中的转录调控的机制,仍然有待深入研究和阐述。
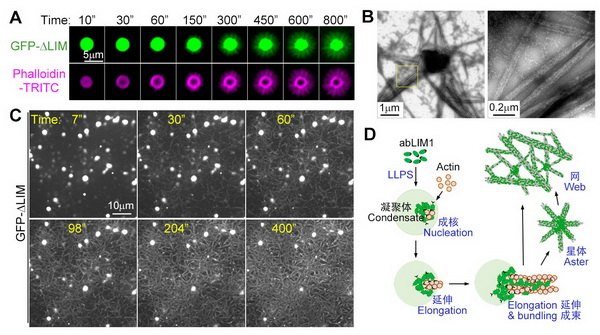
2022年7月12日,清华大学郗乔然课题组在《细胞-细胞报道》(Cell Reports)杂志在线发表题为“HMCES参与协调小鼠胚胎干细胞mESCs中activin/nodal/BMp信号通路的转录调控”(HMCES modulates the transcriptional regulation of nodal/activin and BMp signaling in mESCs)的研究论文。该研究发现,HMCES这个具有DNA损伤修复相关功能的蛋白,在小鼠胚胎干细胞中,能够在不影响DNA损伤的基础上对干细胞的分化潜力进行调控。在转录表达谱分析中发现,HMCES的敲除增强了TGF-β家族信号通路经典靶基因的转录本表达。HMCES 与 R-SMAD 蛋白结合,共同定位于标记转录激活的修饰组蛋白处。然而,HMCES 结合染色质独立于TGF-β家族信号通路。从机制上讲,HMCES 竞争性地结合染色质以限制 R-SMAD 蛋白的结合,从而迫使R-SMAD从染色质解离并导致抑制它们的转录功能,进而影响TGF-β家族信号通路在胚胎干细胞分化中的功能。在非洲爪蟾胚胎中,hmces 敲低会导致显著的发育缺陷,并伴随着左右轴不对称异常以及lefty1 的表达增加。这也表明hmces在非洲爪蟾胚胎早期发育过程中通过影响TGF-β家族信号通路,而影响胚胎发育。总之,该研究揭示了 HMCES参与协调nodal/activin和BMp信号通路的转录调控。
清华大学生命科学学院郗乔然副教授为本文的通讯作者。清华大学2015级已毕业博士生梁涛,2013级已毕业博士生柏见博为并列第一作者。来自清华大学生命科学学院陶庆华教授实验室的博士后朱薛辰、已经毕业的2011级博士生林浩完成了文中的非洲爪蟾胚胎早期发育部分工作。清华大学生命学院郗乔然实验室在读2019级博士生周威、马世鑫为本工作顺利开展作出重要贡献。
本工作获得国家自然科学基金、科技部国家重点研发计划、清华-北大生命科学联合中心的大力支持。
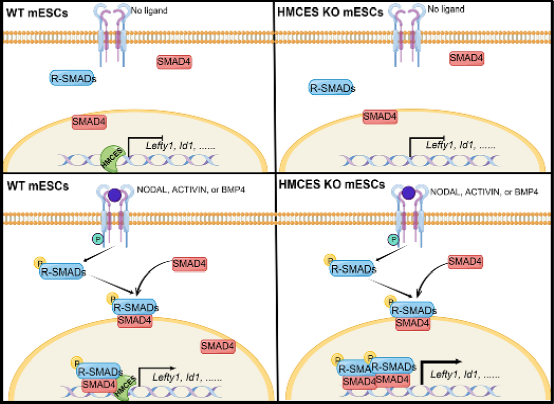
图1:HMCES与SMAD蛋白特异结合,通过空间位阻方式阻滞TGF-β/BMp信号通路直接靶基因的转录过度激活。
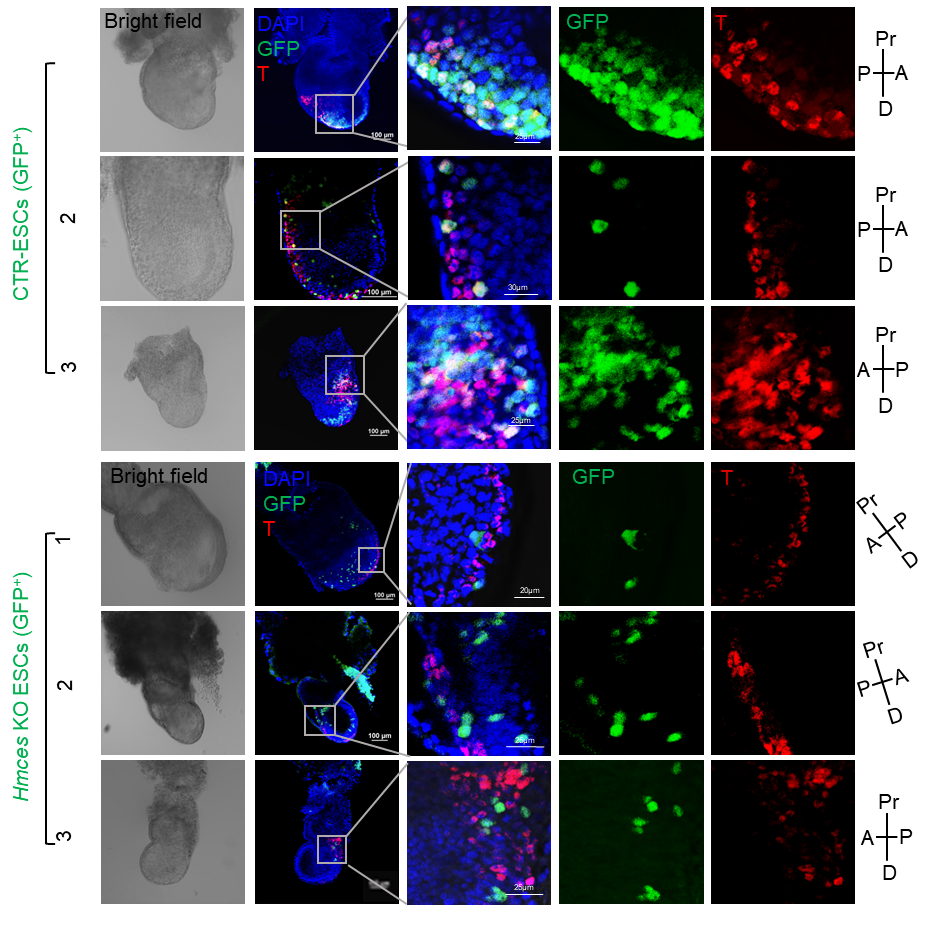
图2:胚胎嵌合实验表明HMCES缺失抑制了小鼠胚胎干细胞产生中内胚层细胞的能力
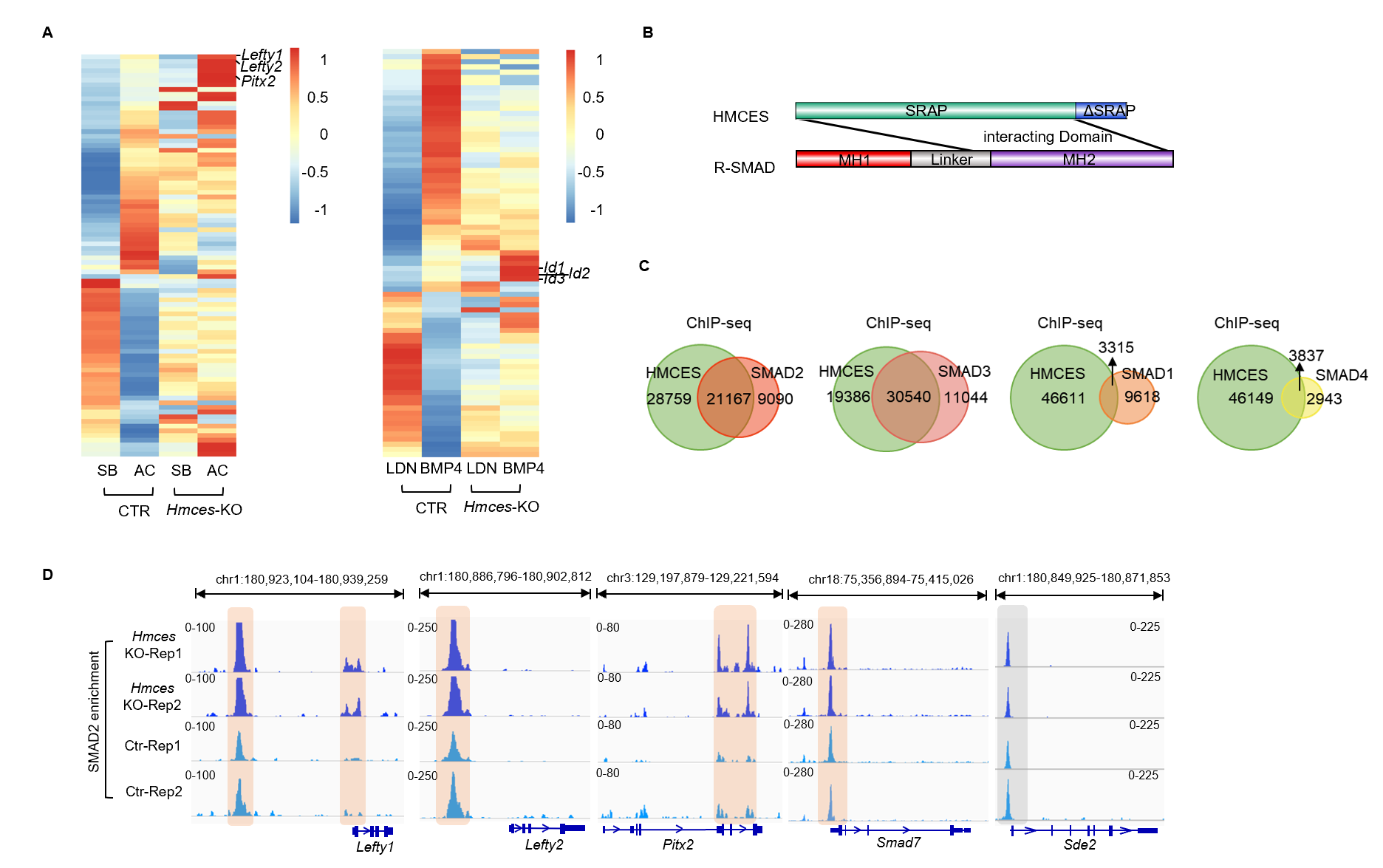
图3:HMCES通过抑制SMAD在靶基因启动子区的结合从而调控TGF-β信号通路靶基因转录不会被过度激活。
论文链接:https://doi.org/10.1016/j.celrep.2022.111038