影响肠道如何使用其基因的微生物
该研究结果发表在《细胞与分子胃肠病学与肝病》杂志上,论文标题为“小肠上皮细胞不同微生物和营养信号的转录整合”。
研究人员写道:“肠道不断解读和适应膳食和微生物刺激的复杂组合。然而,肠道上皮整合这些一致信息来源的转录策略仍未得到解决。我们最近发现,微生物的定植抑制了HNF4核受体转录因子的上皮活性,但它们的整合调节尚不清楚。”
杜克大学分子基因组学和微生物学教授、杜克大学微生物学中心主任约翰·罗尔斯博士说:“肠道是动物和它生活的世界之间的一个迷人的接口,它从饮食和它所携带的微生物中接收信息。”
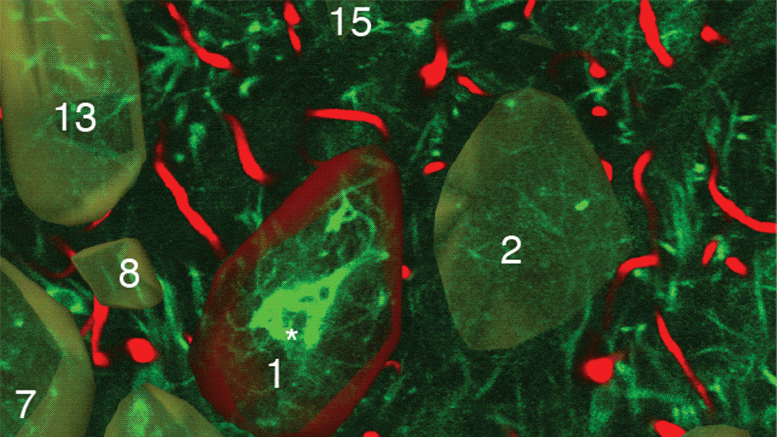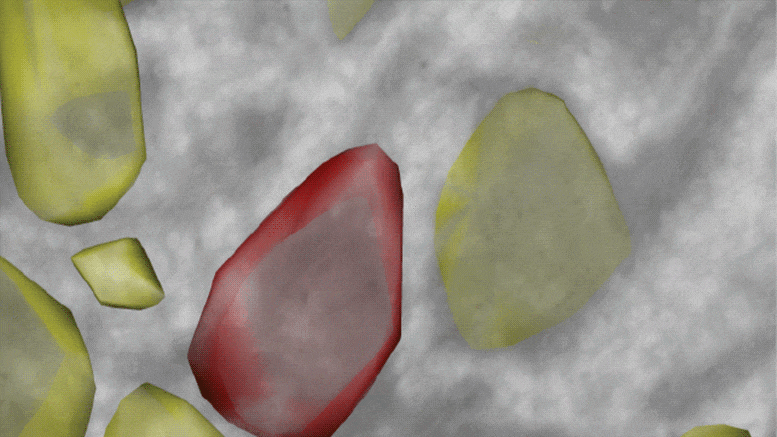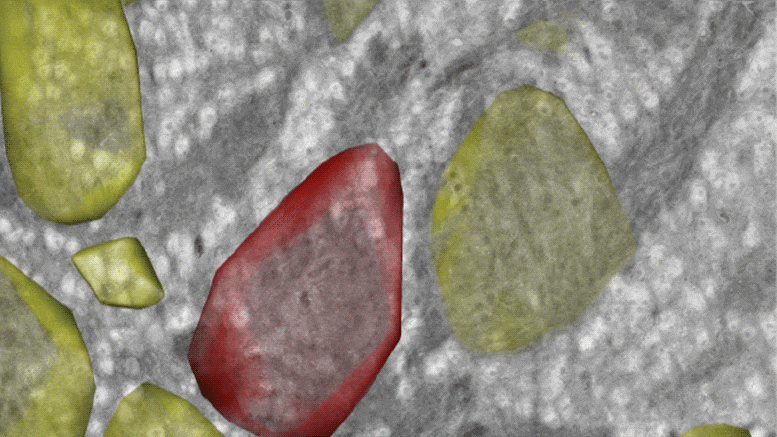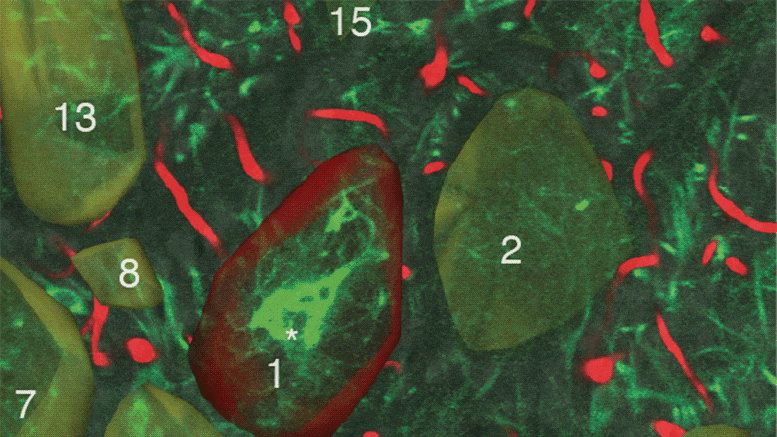
研究人员首先比较了没有肠道菌群的小鼠和肠道菌群正常的鼠。研究人员集中研究了RNA转录和小肠中开启或关闭复制过程的蛋白质之间的相互作用,小肠是脂肪和其他营养物质吸收最多的地方。
无菌小鼠和正常小鼠在高脂肪饮食中都能代谢脂肪酸,而研究人员观察到无菌小鼠在处理高脂肪饮食时使用了一组非常不同的基因。
罗尔斯说:“我们惊奇地发现,肠道上皮细胞对膳食脂肪作出反应的基因剧本是不同的,这取决于是否存在微生物。”
“这是我们实验室和其他实验室多项研究中相对一致的发现,微生物实际上促进了脂质吸收,”罗尔斯实验室的高级研究助理、该论文的第一作者科林·利克瓦尔博士解释说。“在某种程度上,这也会影响体重增加等系统过程。”
无菌小鼠发现参与脂肪酸氧化的基因活性增加,即燃烧脂肪酸,为肠道细胞提供燃料。
罗尔斯解释说:“通常我们认为肠道只是在工作,通过上皮细胞吸收营养物质,与身体其他部分分享,但肠道也必须吃东西。所以我们认为无菌动物的肠道比有微生物时消耗了更多的脂肪。”
利克瓦尔说:“最近有很多论文表明,有很大的能力改变肠道的较大结构,以及单个基因程序。肠道有显著的可塑性。我们在很大程度上不理解它,但这篇论文阐明了其中的一些内容。”
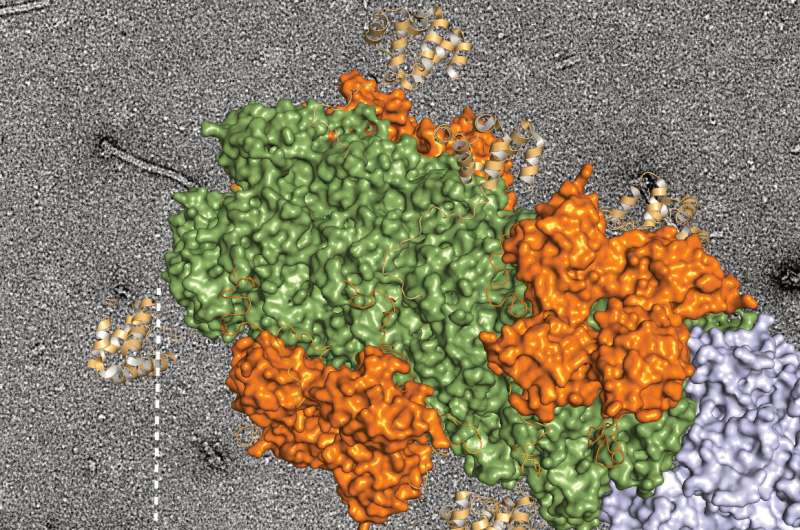
研究人员将注意力集中在一种名为HNF4-Alpha的转录因子上,这种转录因子被认为可以调节脂质代谢和对微生物做出反应的基因。
研究人员发现,HNF4-Alpha在同时整合肠道内的多种信号方面很重要。
罗尔斯总结道:“无菌动物似乎在各个方面都不寻常,这告诉我们微生物群对我们所认为的‘正常’动物生物学的巨大影响。”
研究人员指出:“这确定了肠道适应多种信号的潜在转录机制,以及微生物群如何调节肠道脂质吸收、上皮细胞更新和系统能量平衡。”
“Transcriptional integration of distinct microbial and nutritional signals by the small intestinal epithelium.”