“现成的”工程干细胞治疗侵袭性脑癌
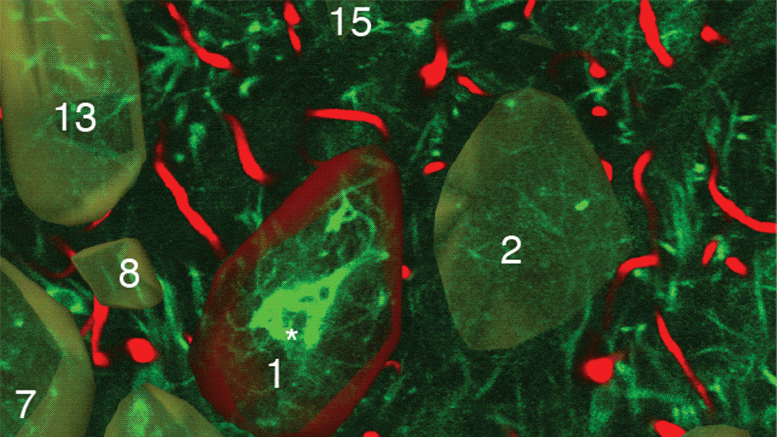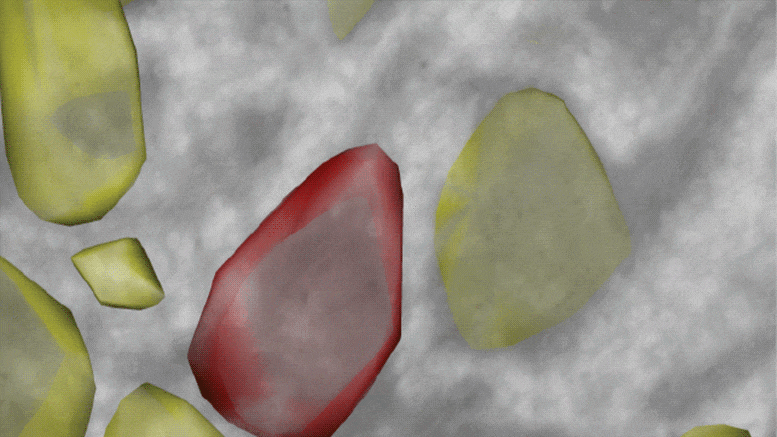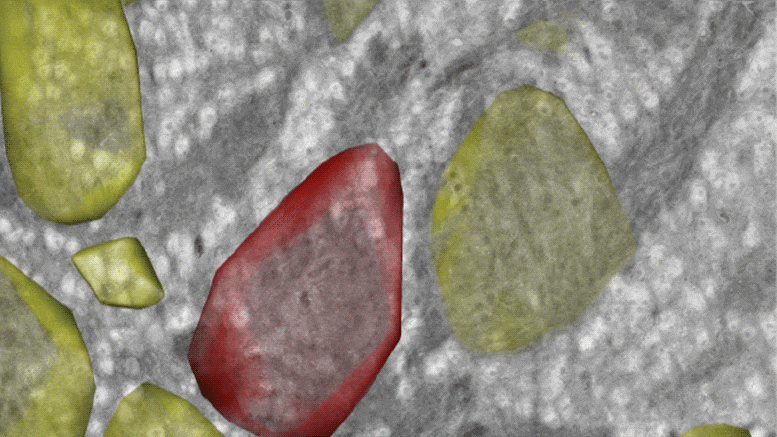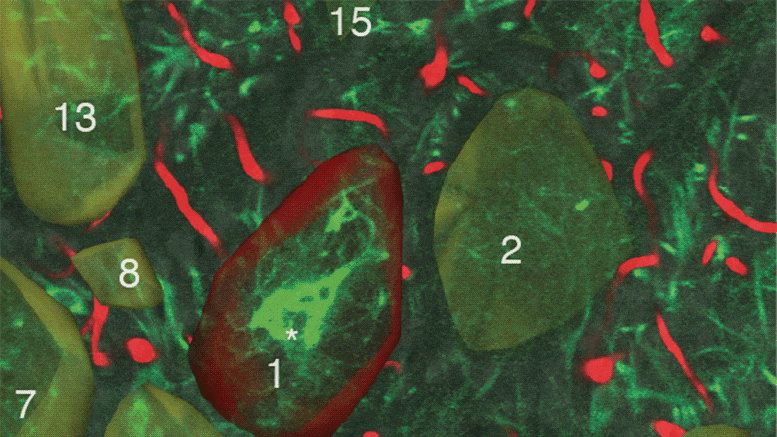
被包裹的干细胞(绿色)追踪并杀死GBM肿瘤细胞(红色)
胶质母细胞瘤(GBMs)是一种高度侵袭性的脑部和脊髓肿瘤。像GBM这样的脑癌治疗具有挑战性,因为许多癌症治疗方法不能通过血脑屏障,而且90%以上的GBM肿瘤在手术切除后复发,尽管手术和随后的化疗和放疗是治疗这种疾病的最成功的方法。在一项由布里格姆妇女医院和哈佛医学院的研究人员领导的新研究中,科学家们设计了一种新的治疗策略,通过使用从健康捐赠者身上提取的干细胞来治疗GBM后的肿瘤细胞。该策略在GBM临床前模型中显示了深远的疗效,100%的小鼠在治疗后存活超过90天。研究结果发表在《Nature Communications》杂志上。
“据我们所知,这是第一个在开始治疗前识别肿瘤细胞上的目标受体的研究,并在GBM肿瘤手术后使用生物可降解的、凝胶封装的、‘现成的’工程干细胞基础治疗。”干细胞和转化免疫治疗中心(CSTI)主任、布里格姆神经外科研究副主任、哈佛医学院和哈佛干细胞研究所(HSCI)教师Khalid Shah说。“在未来,我们将应用这一策略,在一个人被诊断为GBM后迅速识别目标受体,然后使用凝胶封装的、现成的、工程化的干细胞治疗。”
许多以细胞为基础的癌症治疗方法都来自于患者自身的干细胞或免疫细胞。然而,在GBM这样的疾病中,由于疾病进展迅速,大多数患者在确诊后的第一周就接受了手术,几乎没有时间从他们自己的细胞类型中开发治疗方法。相反,科学家们开发了一种新的方法,使用同种异体干细胞,或来自健康个体的细胞,这样就可以在手术时立即进行治疗。Shah和同事评估了几种在大脑中携带干细胞治疗药物的胶囊的疗效,并发现了一种生物可降解的水凝胶胶囊,它可以成功地运输治疗药物,而不会被脑脊液冲走。
研究人员首先使用一种通常在肿瘤细胞上表达的遗传生物标志物,在循环肿瘤细胞(CTC)或血液中的癌细胞上发现了一种被称为“死亡受体”的特殊受体。一旦确定,他们从健康的人类捐赠者的骨髓中提取干细胞,并改造这些细胞,使其释放一种与死亡受体结合并引发细胞死亡的蛋白质。他们还在干细胞系统中建立了一个安全开关,允许通过pET成像跟踪干细胞,一旦激活,就可以根除干细胞,并进一步增加癌细胞的死亡。最后,Shah的团队评估了治疗性双功能细胞(MSCBif)在原发和复发GBM肿瘤术后动物模型中的疗效。
值得注意的是,所有在手术后接受凝胶包裹干细胞治疗的小鼠在治疗后仍然存活90天,相比之下,仅接受手术的小鼠的平均生存时间为55天。研究人员还通过在小鼠身上使用不同剂量的间充质干细胞治疗进行了几项研究,评估了这种临床治疗的安全性。他们在有或没有肿瘤的小鼠中都没有发现毒性的迹象。
这项研究的发现为在未来两年内对接受脑手术的GBM患者进行I期临床试验铺平了道路。Shah及其同事指出,这种治疗策略将适用于更广泛的实体肿瘤,对其应用的进一步研究是有必要的。
Shah说:“除了这种疗法的显著成功率之外,这些发现表明,我们可以使用来自健康个体的干细胞治疗癌症患者。这项工作制定了基金会开始构建一个工程干细胞生物治疗针对不同的受体在肿瘤细胞和肿瘤微环境中的免疫细胞,我们将有一天能够用于治疗各种难治性癌症像GBM。”
Shah拥有AMASA Therapeutics公司的股权,并是该公司的董事会成员,该公司开发基于干细胞的癌症疗法。合著者Deepak Bhere拥有AMASA Therapeutics的股权,同时也是该公司的顾问。资助:本研究由研究基金和AMASA Therapeutics支持。
论文引用:
Bhere Det al.“Target receptor identification and subsequent treatment of resected brain tumors with encapsulated and engineered allogeneic stem cells”Nature CommunicationsDOI: 10.1038/s41467-022-30558-3