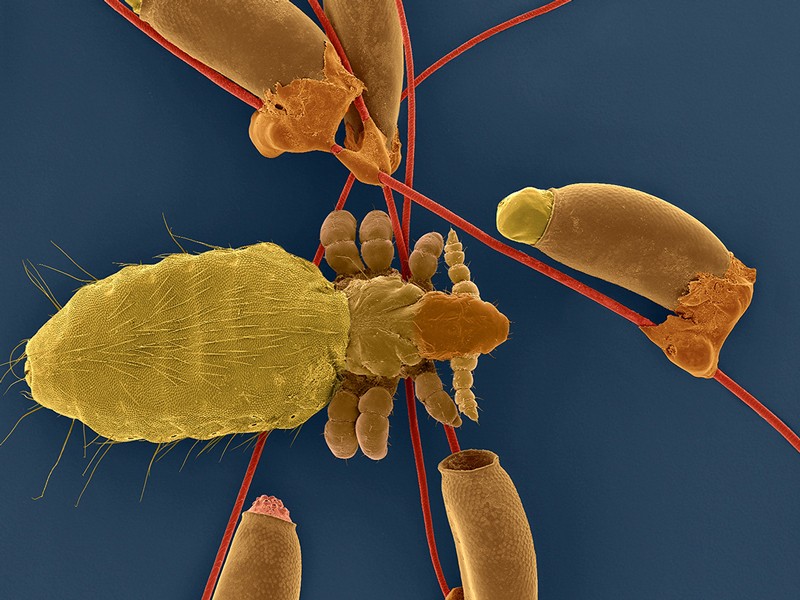
Genome Medicine:罕见突变的汇合
30年前,加州大学圣巴巴拉分校的神经科学家肯尼斯·s·科西克(Kenneth S. Kosik)首次开始研究一个哥伦比亚家庭,该家庭患有一种遗传性的早发性阿尔茨海默病。他和其他研究人员意识到,他们只是触及了西班牙人近五个世纪前进行的殖民活动的表面,这些殖民活动在很大程度上是无形的,但意义深远。
“当我的同事在这个非常大的农村家庭中携带这种突变的个体进行临床试验时,他们需要尽可能多的参与者,”科西克说,回忆起为这项研究招募人员的努力。这个由数千人组成的家庭是独一无二的。携带所谓的paisa突变的成员会像钟表一样,在40多岁时开始出现阿尔茨海默氏症的标志性健忘——他们称之为“波贝拉”。研究人员与哥伦比亚神经系统科学家弗朗西斯科·洛佩拉(Francisco Lopera)合作,试图尽可能大范围地寻找那些生活在该国偏远地区的早发性痴呆症患者,这些患者给哥伦比亚带来了太多不必要的痛苦。
这种情况的程度远远超出了他们的预期——他们的调查产生了可以追溯到几千年前、跨越几个大陆的遗传结果。研究人员的工作发表在《基因组医学》杂志上。
遥远的起源朱莉安娜·阿科斯塔-乌里韦还记得这项研究的早期。当时她是一名医科学生,即将完成学业,并将在一年的社会服务时间里成为一名内科科学家。
阿科斯塔-乌里韦现在是科西克实验室的项目科学家,也是这篇论文的第一作者。他说:“我们接到了1000多个家庭中患有早发性痴呆症的人的电话。”“我们正在测试它们,看看它们是否属于帕伊萨突变家族。”
但是,当他们对这些人进行正式名称为pSEN1 E280突变的测试时,研究人员认为他们的新患者是原始家庭的一个子集的假设消失了。绝大多数的检测结果都是阴性。进一步的测试显示,研究人员集中了一些不相关的家族,这些家族的不同突变导致了相同的可观察特征。
“我们已经非常擅长识别导致神经退行性疾病的不同突变——它们的基因型。”Kosik说。“但我们并不真正了解基因型和表型之间的关系,也就是说,他们的临床表现是什么,他们患的是什么类型的痴呆症,它是如何发生的,受影响的机制是什么。”
基因组测试只揭示了故事的一部分,相关信息一开始似乎只会加深谜团。例如,著名的帕伊萨突变可以追溯到早期西班牙哈布斯堡王朝的一位创始人,而另一个突变可以追溯到西非。还有一种则与美洲原住民有渊源。它们是如何在哥伦比亚的农村出现的?
这一现象的线索可以在哥伦比亚的历史和全球范围内的人口流动中找到。
阿科斯塔-乌里韦说:“人口结构、人口历史和人口流动的许多不同因素形成了阿尔茨海默病目前的风险负担。”在西班牙征服美洲的时期,16世纪初,欧洲人第一次出现在后来成为哥伦比亚的北部海岸,努力在该地区定居和殖民。在那个世纪后期,西非人作为奴役劳工加入了这个群体。
然而,在当时的哥伦比亚,人们并不是唯一的混血儿。
阿科斯塔-乌里韦说:“人们不会独自旅行。“人们会带着虫子旅行。”根据研究人员的说法,这些人将他们的细菌与以前从未接触过的人交换,人群“因多种传染病而大量死亡,包括天花、流感、梅毒、肝炎、麻疹、脑炎、结核病、白喉、霍乱、斑疹伤寒、猩红热和脑膜炎。”
种群的崩溃导致了基因库的缩小——这是一个遗传瓶颈,在这个瓶颈中,少数幸存下来的幸存者,恰巧也拥有这些罕见的突变,成为了后续种群的创始人,将他们的突变传递给他们的后代。随后是漫长的殖民时期,移民速度放缓,人们大多留在原地。新基因的缺乏、孤立的人群和大家庭都有助于在人群中形成突变。
科西克解释说:“如果他们有几代大家庭,这些突变就会被放大,而且会在当地被放大,因为人们没有四处迁移。”“我们在哥伦比亚开始看到的是,基因地图与地理地图重叠,因为你实际上可以将携带突变的人匹配到某个地区。”
这一机制解释了突变如何能够在几代人的种群中增殖。但研究人员的调查引发了另一个难以忽视的问题。
“当你对一个种群施加选择压力,比如病原体,就会产生一个问题,幸存者比死去的人有任何好处吗?”Acosta-Uribe说。这些突变——特别是pSEN1(早老症)基因的变异——是否在殖民初期赋予了携带者某种保护,以抵御传染病的冲击,从而确保了他们的生存?
阿科斯塔-乌里韦说,这不会是一个不寻常的情况。
她说:“有很多例子表明,那些携带在其他条件下可能有害的基因变异的人会被选择。”例如,她指出,患有镰状细胞性贫血的人是杂合子(来自父母一方的一个突变基因副本和来自另一方的一个正常基因副本),他们对严重的疟疾有抵抗力。导致镰刀形细胞的突变也“干扰了疟原虫的繁殖周期”。
Kosik说,不幸的是,这些pSEN1突变帮助它们的携带者抵御致命传染病的观点可能永远只是猜测。
“我们不能重放生活的磁带,”他说。“我们无法重现那里发生的一切来证明这一点,但这是相当可信的。”在这个谜团中,有两个诱人的间接证据:仅在哥伦比亚队列研究中就发现了13个pSEN1基因突变(对于哥伦比亚这样一个国家的规模和人口来说,这些罕见突变的浓度“统计上不寻常”),以及导致阿尔茨海默病特有的粘性不溶性斑块的多肽的抗菌特性。
“事实证明,淀粉样肽可能具有抗菌功能;有一种非常古老的保护系统来抵御入侵的生物,其中一种抗菌肽会粘在入侵的生物上,并将其与身体的其他部分隔离开来。”人们猜测,这种特殊的突变可能是被积极选择的,也许是因为它保护人们免受疾病。科西克补充说,他的实验室正在通过更深入地研究他们队列中的基因组来研究这种影响,但这充其量只是一个统计上的论点。
随着Kosik实验室继续其工作,一项重大临床试验的结果即将出炉,很明显,他们生成的庞大的基因组数据集只是全球人口疾病遗传学研究的冰山一角。
阿科斯塔-乌里韦说:“我们生成了一个独特的数据集,可以帮助我们了解非白人人口疾病的基因。”她补充说,大部分基因组数据集中在欧洲的基因组上,这可能会掩盖人类中与基因相关的疾病的大部分情况。在突变及其生理结果之间的联系上尤其如此。
例如,阿科斯塔-乌里韦在该项目的基因组调查中发现,在欧洲出现的ALS(也被称为卢伽雷氏病)突变和病理在美洲原住民谱系中出现的是额颞叶痴呆。此外,通过追溯美洲原住民的突变,她发现它起源于美洲的第一批人口。
阿科斯塔-乌里韦说:“我们将携带这些变异的哥伦比亚人与携带这种变异的亚洲人进行了比较,我们确认,哥伦比亚人确实从他们的祖先那里得到了这种基因,这些祖先在3万多年前通过白令海峡迁徙到美洲,并在那里定居。”
回到现在,这一新知识可以为哥伦比亚队列的成员提供一些线索,解释为什么阿尔茨海默病的遗传形式在他们的家族中如此普遍。它还强调了在努力了解和治疗这种尚未治愈的疾病方面合作的价值。一个亮点是:家族中有一名携带paisa突变的女性一生中都没有患上阿尔茨海默病,这可能是因为这种罕见基因突变的第二个副本消除了这种疾病的两个标志:淀粉样β斑块(死后在她的大脑中发现)和陶蛋白缠结(未发现)。
阿科斯塔-乌里韦说:“这篇论文使我们与科学界以及哥伦比亚的家属建立了紧密的联系。”“我们能够向家属解释为什么会发生这种情况,并告诉他们,虽然我们可能还无法治愈他们,但我们会与他们在一起。”