Science子刊:将CRISPR-Cas9意料不到的基因改变影响降到最低
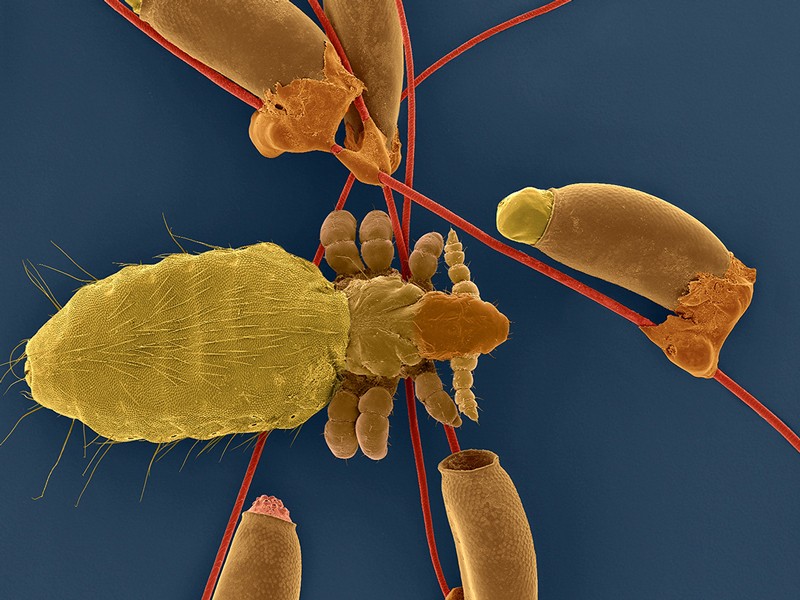
图片:从基因修复的人类造血干细胞分化的细胞群。只有修复后的干细胞才能形成这样的集落。
资料来源:MDC的Klaus Rajewsky实验室
CRISpR-Cas9分子工具可用于治疗遗传性血液疾病,但这可能会导致意想不到的基因改变。MDC的研究人员Klaus Rajewsky和Van Trung Chu领导的一个小组现在在《科学进步》中提出了一种方法,可以将这种不良后果降到最低。
CRISpR-Cas9基因编辑工具的治疗潜力被寄予厚望。这些“分子剪刀”可以用来非常精确地切割和修复导致遗传疾病的基因突变。但是,尽管该工具能够精确地定位基因组中的目标,它的工作还不是完全没有错误。
有时,剪切位点与目标序列非常相似,但位于完全不同的DNA区域。这些错误被科学家称为“脱靶突变”,可能会产生意想不到的后果。即使CRISpR-Cas9在正确的位点进行切割,当切割被修复时也会发生错误——这种现象被称为“脱靶突变”。
把切口隔开
Helmholtz协会(MDC)柏林Max Delbrück分子医学中心免疫调节和癌症实验室主任Klaus Rajewsky教授解释说:“这些错误的发生主要是因为,在经典的方法中,DNA分子的两条链同时被切断。”这位科学家现在在《科学进展》杂志上提出了一种被称为“spacer-nick”的新改进方法。这种方法使用了一种改良的分子剪刀,被称为nickases,它在DNA的两个不同点上对相反的DNA链造成刻痕。
但是,这对基因编辑组合能够更精确地检测和修复有缺陷的基因,在很大程度上取决于该团队在工具中内置的一个间隔器。Rajewsky实验室的科学家、与Rajewsky本人共同撰写这篇论文的作者Van Trung Chu博士解释说:“我们使用这种间隔物来确保两个缺口相隔200到350个碱基对,从而避免DNA中的双链断裂。”“我们对造血干细胞和T细胞的实验表明,这是最大限度减少靶内和脱靶突变的最佳距离,”Chu说。“再短一点,我们就有可能剪断整个DNA分子——尽管使用了两把独立的剪刀。”
另外两个MDC团队——Kathrin de la Rosa教授的癌症与免疫学/免疫机制和人类抗体实验室,以及Ralf博士Kühn的基因组编辑与疾病模型实验室也对这篇论文做出了重要贡献,特别是在检测脱靶突变方面。Rajewsky说:“因此,Spacer-nick也是研究中心不同实验室的研究人员成功合作的一个很好的例子。”
有效,几乎没有错误
科学家们甚至可以量化他们的微调基因剪刀和抵消双缺陷的优势:“使用经典的CRISpR-Cas9方法,在40%以上的干预中发生目标突变,”Chu报告说。“Spacer-nick系统可以将这一比例降低到2%以下。”
无法轻易准确地确定脱靶突变是否成功,“我们只能说,当使用经典的基因剪刀时,脱靶突变发生得相对频繁,但在我们的方法中,这种情况即使不是不存在,也是罕见的。”目前尚不清楚的是遗传物质在间隔切口后修复的确切机制。“这似乎不是通过众所周知的,而且容易出错的NHEJ途径发生的,”Chu说。
就有效性而言,Spacer-nick与常规工具相当:“在这两种方法中,我们能够成功修复20%到50%的处理过的细胞,”Chu说。他解释说,这可能已经足够治愈那些患有遗传性血液疾病的病人了,这种疾病只源于一个被改变的基因。这类疾病的例子包括β地中海贫血,它涉及血红蛋白合成错误,或严重的先天性中性粒细胞减少症,其特征是粒细胞(一种白细胞)数量显著减少,与严重削弱的免疫防御有关。
干细胞修复
Chu和Rajewsky希望其他研究人员也能接受他们的想法,首先在动物模型上测试Spacer-nick,然后很快在第一批人类患者身上测试。Chu解释说,这种疗法背后的原理很简单:造血干细胞是用现有的方法从患有单基因遗传疾病的人身上提取的。然后,Spacer-nick在细胞培养中直接修复有缺陷的基因。一旦基因剪刀完成工作,修复后的干细胞就会被送回患者体内——在那里它们会产生新的,最重要的是,健康的血细胞。
文章标题precise CRISpR-Cas–mediated gene repair with minimal off-target and unintended on-target mutations in human hematopoietic stem cells