新的镰状细胞病基因疗法全靠找到正确的小鼠
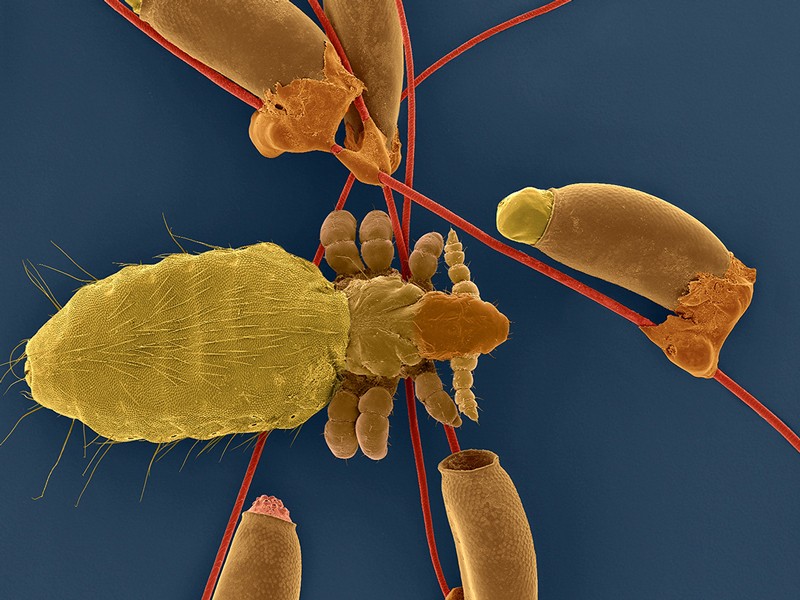
图片:患有镰状细胞病的人类红细胞
图片由Weiss实验室提供。
镰状细胞病是一种极其令人衰弱的疾病,影响非洲国家多达40%的人口,患者遭受剧痛、器官损伤和预期寿命缩短。这种疾病是由制造血红蛋白(血红蛋白是血红细胞中携带氧气的蛋白质)的基因突变引起的,受损的血红蛋白扭曲了血红细胞的形状,导致血管阻塞,造成疼痛,并可能危及生命。然而,科学家们已经意识到,增加这种蛋白质(通常只在子宫中产生的胎儿血红蛋白)的健康形式的产量,可以为这些患者提供革命性的治疗。在他们最新的《疾病模型与机制》文章中,来自美国孟菲斯圣犹大儿童研究医院的Mitchell Weiss和同事们研究了Weiss实验室正在开发的一种有前景的新治疗方法,他们通过编辑基因来启动成人红细胞中这种健康的、胎儿血红蛋白的产生。当在小鼠身上测试这种疗法时,研究人员发现,尽管实验室小鼠有镰状细胞病的症状,但胎儿血红蛋白基因和周围的DNA没有正确配置,这使得这种革命性的干细胞疗法在动物身上无效,甚至是有害的,并引发了人们对未来在这些实验室小鼠身上测试新的基于基因的疗法的研究的担忧。
在一种新的治疗方法可以在人身上试验之前,科学家们先在实验动物身上试验它们,所以Weiss和同事们在两种携带镰状细胞病症状的小鼠身上试验了他们的新基因疗法:所谓的“伯克利”小鼠和“汤斯”小鼠。首先,他们从小鼠体内取出干细胞(骨髓中的细胞被编程成红细胞),并使用基因编辑技术修改干细胞的部分DNA,以启动健康胎儿血红蛋白基因。然后,科学家们将这些重新编程的干细胞放回老鼠体内,并对这些动物进行18周的监测,以找出治疗对它们的影响。
令人惊讶的是,70%的伯克利小鼠死于治疗,它只激活了3.1%小鼠干细胞中愈合的胎儿血红蛋白基因的产生。相比之下,唐斯小鼠的实验治疗激活了57%的红细胞中的胎儿血红蛋白基因,但没有影响动物的生存。然而,Townes小鼠的红细胞中产生的胎儿血红蛋白水平比在实验室培养的人类细胞中使用这种方法时低7- 10倍,而且还没有高到足以减少镰状细胞病的临床症状。
Weiss和他的同事想找出为什么这种新的治疗方法在伯克利老鼠身上没有成功,这些老鼠已经被用来测试镰状细胞病的治疗方法几十年了。韦斯博士说:“我们意识到,我们对这些老鼠的基因配置了解不够。”因此,研究小组对伯克利小鼠的血红蛋白基因和周围DNA进行了测序,发现小鼠并不是只有一个突变的人类基因拷贝,而是有22个随机排列的、破碎的突变人类镰状细胞病基因拷贝和27个人类胎儿血红蛋白拷贝,研究小组希望通过激活这些基因来治愈小鼠的疾病。当科学家们在伯克利的老鼠身上测试基因疗法时,这种复杂的基因构成造成了致命的影响,因为编辑一个基因的多个副本会破坏DNA。这意味着研究人员不能使用这些小鼠来测试和优化这种基因编辑治疗。
相比之下,汤恩斯的小鼠只有变异的人类血红蛋白基因和制造人类胎儿血红蛋白的基因的单个拷贝。然而,这些小鼠可能缺乏正常情况下调节人类胎儿血红蛋白基因产生的关键DNA片段。因此,他们无法产生足够的这种健康蛋白质来缓解小鼠的症状。Weiss博士评论道:“我们的发现将帮助使用伯克利和汤斯小鼠的科学家们决定使用哪一种小鼠来解决与镰状细胞病或血红蛋白有关的特定研究问题。此外,这项工作提醒科学家们仔细考虑他们用来研究人类疾病的老鼠的基因,并找到合适的老鼠。”
文章标题Limitations of mouse models for sickle cell disease conferred by their human globin transgene configurations