人类细胞的“自我修饰”竟能提高COVID-19病毒刺突蛋白的灵活性
伊利诺伊大学的研究人员创建了在COVID-19感染和免疫中发挥关键作用的刺突蛋白的原子级模型,揭示了该蛋白在寻求与受体接触时如何弯曲和移动。
伊利诺伊大学香槟分校的一项新研究发现,当导致COVID-19的冠状病毒感染人类细胞时,细胞的蛋白质处理机制会对刺突蛋白进行修改,使其更灵活和移动,这可能会增加其感染其他细胞和躲避抗体的能力。
研究人员为突刺蛋白创建了一个原子级的计算模型,并进行了多次模拟,以检查蛋白质的动力学,以及细胞的修改如何影响这些动力学。研究人员表示,这是首次对这种在新冠病毒感染和免疫中发挥关键作用的蛋白质进行如此详细的研究。
生物化学教授Emad Tajkhorshid、博士后研究员Karan Kapoor和研究生Tianle Chen在《pNAS》上发表了他们的发现。
Tajkhorshid也是贝克曼先进科学技术研究所的成员,他说:“S蛋白的动态非常重要——它移动的幅度有多大,它在宿主细胞上寻找和结合受体的灵活性有多大。为了有一个真实的表现,你必须在原子水平上观察蛋白质。我们希望我们的模拟结果可以用于开发新的治疗方法。与其使用蛋白质的一个静态结构来寻找药物结合袋,我们希望复制其运动,并使用它采用的所有相关形状来提供一个更完整的平台来筛选候选药物,而不是只使用一种结构。”
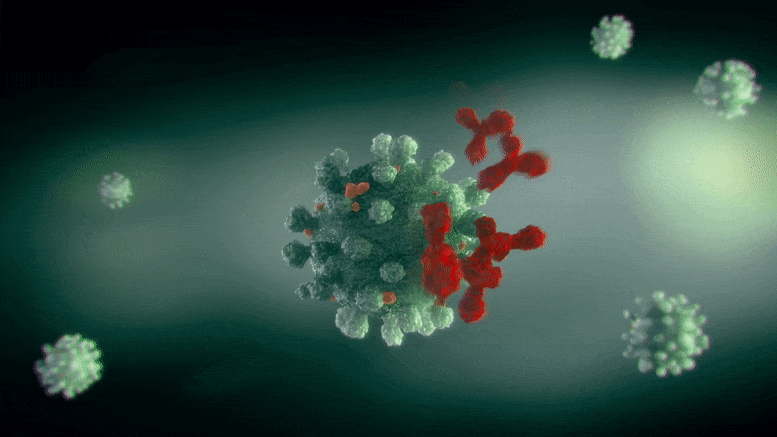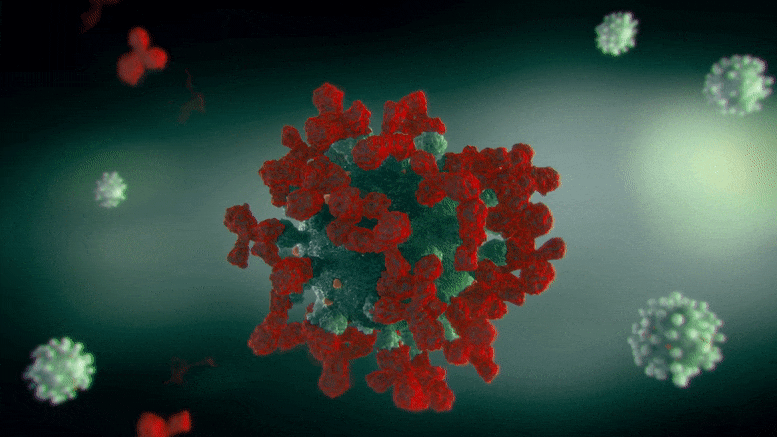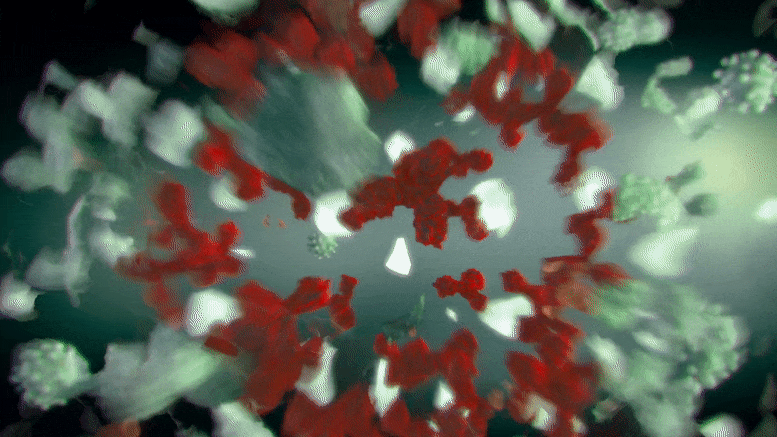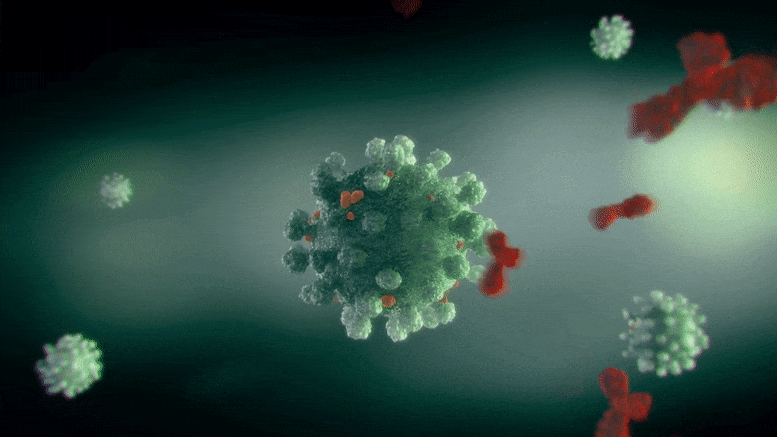
导致COVID-19的SARS-CoV-2病毒的刺突蛋白是一种从病毒表面突出的蛋白质,它与人类细胞表面的受体结合并感染它们。对于接种过疫苗或从感染中康复的人来说,它也是抗体的目标。
Tajkhorshid说,许多研究都着眼于刺突蛋白及其氨基酸序列,但对其结构的了解很大程度上依赖于静态图像。原子模拟让研究人员得以一窥这种蛋白质如何与它试图感染的细胞上的受体以及试图与它结合的抗体相互作用的动力学。
他们发现,这种蛋白质有几个“铰链”或活动部件,使蛋白质的头部可以在病毒突出的茎上旋转。研究人员记录了几种不同的构象,包括活性构象和非活性构象,并绘制了蛋白质如何从一种形式转换到另一种形式的地图。研究人员说,他们在计算模拟中看到的构象与实验结构研究中观察到的角度类型和频率一致,这为模拟的有效性提供了支持。
研究人员还发现,宿主细胞的处理改变了病毒蛋白的动力学。很多研究都集中在病毒的遗传密码以及随着新的变异出现而产生的突变上。然而,刺突蛋白在折叠和“打包”运输到细胞各处时经历了许多变化。最常见的一种修饰是糖基化,即在特定的点添加糖链。
“我们对这些翻译后修饰知之甚少。已经注意到的主要作用是聚糖保护蛋白质免受抗体的靶向作用,”Chen说。“我们比较了穗蛋白的糖基化和非糖基化形式,发现两者之间存在显著的动态差异。”
研究人员注意到,突刺蛋白的运动范围增强了,使其更能弯曲并与细胞表面受体相互作用。聚糖本身也与细胞膜相互作用,使刺突蛋白移动并沿着细胞膜寻找受体。
“糖基化不仅提供了一个免疫屏障,而且还介导和增强了刺突的流动性,增加了病毒成功附着和感染人类细胞的机会。因此,这些翻译后修饰的功能比最初认为的要广泛得多,”Kapoor说。“这一认识现在可以为靶向这种病毒的功能提供额外的机会。”
研究人员说,他们的发现强调了不仅要了解新病毒变种刺突蛋白的基因突变,还要了解糖基化等修饰,以及这些修饰如何增加病毒的传染性和免疫回避能力的重要性。他们还预计其他研究人员将利用他们的模型开发新的诊断方法、疫苗和抗病毒药物。
“希望在未来的道路上,这种对刺突蛋白的新理解将有助于治疗努力。我想我们可以用结合在糖链上的化合物来针对刺突蛋白的动力学,使它们变得不灵活,因此在原则上降低病毒的效力,”Tajkhorshid说。
posttranslational modifications optimize the ability of SARS-CoV-2 spike for effective interaction with host cell receptors