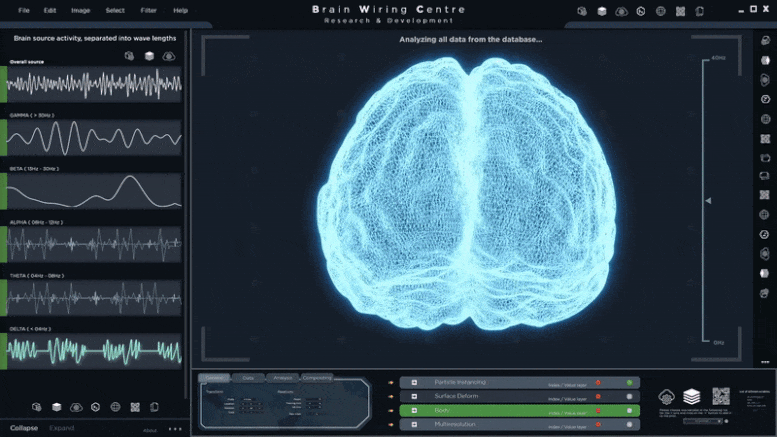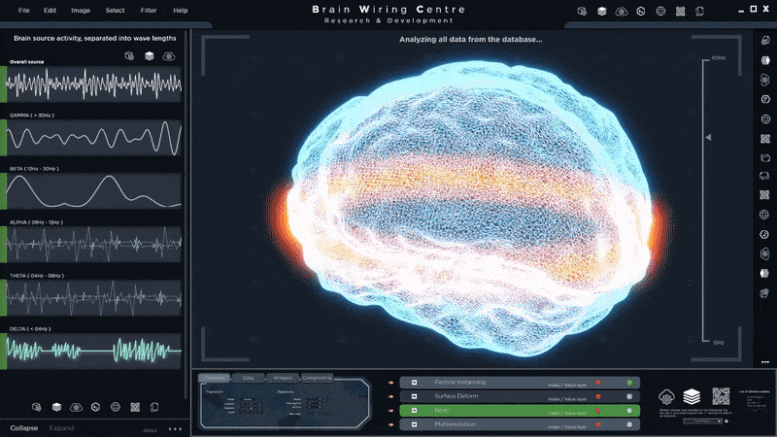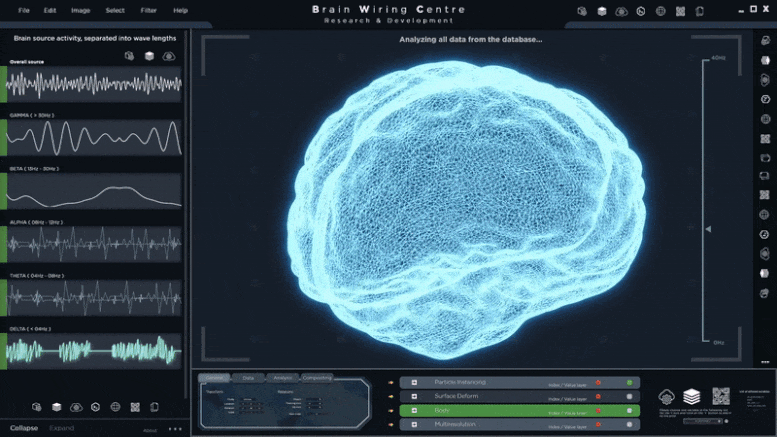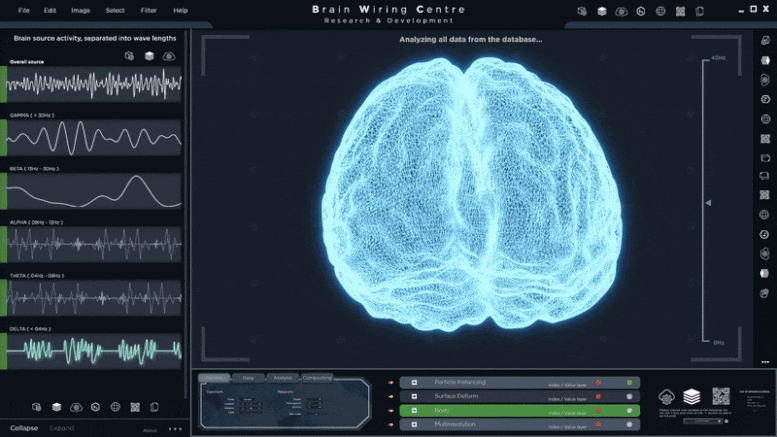
巨噬细胞抗菌新机制:通过TFEB激活吞噬溶酶体-线粒体互作 线粒体生产抗菌代谢物衣康酸
巨噬细胞是我们先天免疫反应的关键细胞,这些细胞几乎遍布我们身体的所有组织,在维持我们器官的健康状态方面起着至关重要的作用。巨噬细胞特别擅长吸收、消化和破坏外来物质,它们会不断清除死亡细胞或入侵组织的微生物或病原体。然而,某些微生物和细菌,如沙门氏菌或分枝杆菌,已经发展出保护自己免受巨噬细胞消化的策略,往往能够在巨噬细胞的消化系统中存活并逃脱免疫细胞的控制,从而导致严重的伤寒感染和炎症。来自Max planck研究所的免疫生物学和表观遗传学科学家们发表在科学杂志《自然代谢》上的最新研究报告详细表述了巨噬细胞如何通过吞噬溶酶体和线粒体之间的一种相互作用激活了更有效的抗菌防御机制以抑制沙门氏菌,这有助于更好地了解免疫细胞如何工作,并可能确定治疗传染病的新干预点。
消化细胞器发出的信号
和大多数其他细胞一样,巨噬细胞的内部被细分为几个不同的区隔。这些所谓的“细胞器”各自承担细胞内的特定功能,类似于人类的器官系统,在我们的身体中承担特定的角色。作为专业的清除细胞,巨噬细胞有一个非常突出的消化细胞器,即吞噬溶酶体,被吞噬的微生物通常会被降解成碎片并失活——吞噬细胞中细菌的成功消除发生在吞噬溶酶体系统中,但也取决于线粒体途径。然而,这两个细胞器系统如何通信在很大程度上是未知的。
“人们早就知道分子TFEB(转录因子EB)对吞噬-溶酶体系统的调节很重要。最近的证据也表明TFEB支持抵抗细菌,”马克斯·普朗克小组负责人Angelika Rambold说。她和她的团队想要了解TFEB是如何在巨噬细胞中介导其抗菌作用的。他们的研究证实了早期的发现,广泛的微生物、细菌和炎症刺激激活TFEB,从而激活吞噬-溶酶体系统。“病原体信号触发TFEB是有道理的,因为巨噬细胞在吞噬细菌后需要一个更活跃的消化系统。但是,有趣的是,实验还揭示了TFEB激活对另一个细胞内细胞器系统——线粒体的额外强烈影响。这对我们来说是完全出乎意料和新奇的,”Angelika Rambold说。
指导线粒体增加抗微生物活性
线粒体被称为“细胞的发电站”。这些细胞器由线粒体内外膜组成,是细胞呼吸和从营养物质中释放能量的主要场所。此外,免疫细胞中的线粒体最近被确定为抗微生物代谢物的来源。通过包括代谢组学、分子生物学和成像技术等实验工具,马克斯普朗克的研究人员确定了控制溶酶体和线粒体之间意想不到的相互作用的途径。巨噬细胞利用广泛的细胞器间交流:溶酶体激活TFEB, TFEB进入细胞核,在那里它控制一种名为IRG1的蛋白质的转录。这种蛋白质被导入线粒体,作为主要酶产生抗微生物代谢物衣康酸itaconate,”Angelika Rambold解释。
研究结果确定了溶酶体的转录因子 EB (TFEB) 作为巨噬细胞中吞噬-溶酶体-线粒体相互作用的调节剂。通过结合细胞成像和代谢分析,他们发现响应细菌刺激的 TFEB 激活促进了乌头酸脱羧酶 (Acod1, Irg1) 的转录及其产物衣康酸(itaconate)的合成——这是一种具有抗菌活性的线粒体代谢物。TFEB-Irg1-衣康酸信号轴的激活降低了液泡内病原体鼠伤寒血清型沙门氏菌的存活率。TFEB 驱动的衣康酸随后通过 Irg1-Rab32-BLOC3 系统转移到含沙门氏菌的液泡中,从而使病原体暴露于升高的衣康酸水平。通过激活衣康酸的产生,TFEB 选择性地限制沙门氏菌的增殖——沙门氏菌是一种通常能逃避巨噬细胞控制的细菌亚群。这与 TFEB 在自噬介导的病原体降解中的作用形成鲜明对比。
利用细胞器通讯控制细菌感染
研究人员探索了他们是否可以利用这种新发现的途径来控制细菌的生长。Angelika Rambold说:“我们推测,激活这一途径可以用于针对特定的细菌物种,如沙门氏菌。”沙门氏菌可以逃脱吞噬-溶酶体系统的降解。他们设法在巨噬细胞内生长,这可能导致这些细菌扩散到受感染的身体的其他器官,”Würzburg大学的合作科学家亚历山大·威斯特曼解释说。
当研究人员在小鼠感染的巨噬细胞中激活TFEB时,TFEB- irg1 -itaconate途径抑制了细胞内沙门氏菌的生长。这些数据表明,溶酶体-线粒体相互作用代表了一种抗菌防御机制,以保护巨噬细胞不被利用为细菌的生长生态位。
耐多药的超级细菌的出现越来越令人担忧,预计到2050年每年将有1000多万人死于耐药细菌,确定新的战略以控制逃脱免疫机制的细菌感染变得十分重要。利用tfe - irg1 -衣康酸途径或衣康酸本身治疗衣康酸敏感菌引起的感染可能是一种有前途的途径。然而,还需要做更多的工作来评估这些新的干预点是否能成功地应用于人类。