我室陈明周研究组SLC35B2在肠道病毒71型感染所需的硫酸化中发挥双重作用
近期,武汉大学病毒学国家重点实验室陈明周教授研究组在病毒学权威期刊Journal of Virology杂志上在线发表了题为“SLC35B2 Acts in a Dual Role in the Host Sulfation Required for EV71 Infection”的最新研究论文,首次揭示了宿主因子SLC35B2通过调控细胞内的硫酸化水平介导EV71复制的分子机制。
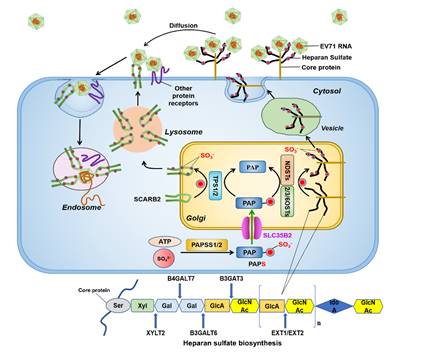
肠道病毒71型(Enterovirus 71,EV71)主要影响五岁以下的婴幼儿,是世界范围内引起婴幼儿手足口病(hand-foot-and-mouth disease, HFMD)的主要病原体之一。同时,作为继脊髓灰质炎病毒(poliovirus)消灭之后最重要的嗜神经RNA病毒,其感染有时会导致严重的神经系统并发症,如脊髓灰质炎样急性弛缓性麻痹、肺水肿、心肌炎、无菌性脑膜炎和脑干脑炎等。尽管自1969年EV71发现以来,不断有关于EV71的研究报道,但是关于EV71的发病机制、宿主免疫系统如何对病毒作出反应以及这些反应背后的分子机制仍知之甚少。基于此, 在本研究中,研究人员采用了人类全基因组水平的CRISpR-Cas9敲除文库对EV71进行了系统筛选,发现溶质载体家族35成员B2(SLC35B2)在EV71复制中是必不可少的。
随后的分子机制探究表明,敲除SLC35B2导致EV71的吸附和内化显著降低,并且EV71的感染效率和宿主细胞的硫酸化水平呈正相关,而不仅仅是简单地和硫酸乙酰肝素(HS)的数量有关,这表明除了硫酸乙酰肝素外还有未被鉴定的硫酸化蛋白参与到EV71感染中。为了支持这一假设,研究人员在EV71众多的蛋白受体中筛选可能被硫酸化修饰的蛋白,结果证实只有SCARB2可以和人类两种酪氨酸蛋白磺基转移酶(TpST)具有明显的相互作用。进一步,利用质谱的方法对SCARB2进行了硫酸化修饰分析,一共鉴定到5个可能的硫酸化位点。功能验证性试验表明,SCARB2上的硫酸化位点不止这5个,更多的位点还有待进一步确认。
本研究的发现丰富了对EV71进入宿主细胞阶段的认识,发现了EV71唯一脱衣壳受体SCARB2具有全新的酪氨酸硫酸化修饰,该修饰和HS的硫酸化修饰共同受到宿主因子SLC35B2的控制。该研究有助于系统性了解宿主因子如何影响EV71的生命周期,并为抗EV71病毒药物提供新的潜在靶点。
武汉大学生命科学学院/病毒学国家重点实验室博士生郭冬为该论文的第一作者,陈明周教授和覃雅丽副教授为该论文的共同通讯作者。武汉大学于兴海博士和周宇教授为本研究的生物信息学分析提供了大力支持和帮助。该研究得到了国家重点研发计划(2021YFC2300702 and 2021YFC2300200)和国家自然科学基金(82130064, 81825015, and 81871650)的联合资助。
论文链接:https://journals.asm.org/doi/10.1128/jvi.02042-21。






























