营养与健康所邱菊组合作发现Setd2对3型天然淋巴细胞和肠道免疫的调控作用
2022年3月15日,国际学术期刊Cell Reports在线发表了中国科学院上海营养与健康研究所邱菊研究组合作的题为" Setd2 determines distinct properties of intestinal ILC3 subsets to regulate intestinal immunity "的最新研究成果。该研究探索了Setd2对3型天然淋巴细胞亚群的表观和转录调控机制。
Setd2(SET-domain-containing 2)是哺乳动物组蛋白H3亚基36位赖氨酸(H3K36)甲基转移酶,可以将H3K36me2 修饰为H3K36me3,是表观遗传中的重要调控分子。3型天然淋巴细胞(Group 3 innate lymphoid cells,ILC3)是大量存在于肠道的一群固有免疫细胞,按照表面蛋白NKp46和CCR6可以进一步划分为三个亚群,分别是:NKp46+ILC3、双阴性(Double negative,DN)ILC3和CCR6+ILC3。ILC3的三个亚群在转录因子表达、细胞因子分泌、空间定位等具有表型和功能上的异质性,在肠道感染、炎症性疾病和肿瘤等疾病中发挥重要调控作用。虽然对于ILC3亚群分化的转录调控机制已有一些报道,但影响组蛋白、DNA修饰的表观遗传机制是否以及如何参与ILC3的分化和功能仍不清楚。
本研究发现Setd2可以维持小鼠肠道ILC3的自稳态并对ILC3的亚群分布和功能有调控作用,进而影响RORγt+调节性T细胞(Regulatory T cells,Treg)和肠道免疫应答。Setd2的缺失会导致总ILC3细胞自身丰度的减少,同时NKp46+ILC3亚群会呈现比例增加,且高表达细胞毒性相关分子(主要为Granzyme A和Granzyme C),且在体内抑制黑色素瘤的生长。另一方面,Setd2缺失的CCR6+ILC3亚群呈现细胞数减少和功能下降,同时伴随肠道孤立肠淋巴组织(Solitary intestinal lymphoid tissue,SILT)形成缺陷。适应性免疫系统重建实验发现在ILC3中特异性缺失Setd2的Rag1-/-小鼠易感于肠道炎症并伴随RORγt+Treg的稳态维持缺陷。Treg是具有免疫抑制功能的辅助性T细胞亚群,肠道中较为富集的、可由肠道微生物诱导产生的RORγt+Treg是一群高表达IL-10 、具有免疫抑制功能的Treg亚群,对抑制肠道炎症有关键作用。RORγt+Treg的稳态维持缺陷可能是由于Setd2缺陷的NKp46-ILC3分泌GM-CSF降低,继而导致CD11b+CD103+树突状细胞(Dendritic cell,DC)减少导致的。研究人员进一步通过ATAC-seq的手段发现Setd2可通过影响ILC3亚群的染色质可及性从而调控基因表达。该工作初步探索、关联了调控ILC3亚群分化和功能的表观机制和转录机制。
中国科学院上海营养与健康研究所博士生畅佳丽为该论文的第一作者,邱菊研究员和上海交通大学生物医学工程学院李力研究员为共同通讯作者。本研究在清华大学胡小玉教授大力支持下完成。特别感谢中国科学院上海营养与健康研究所秦骏研究员、清华大学郭晓欢教授、多伦多大学的Dr. Juan Carlos Zú?iga-pflücker、中国科学院上海巴斯德研究所刘星研究员对本工作的帮助。同时感谢冯德春博士对本工作的帮助。该研究得中国科学技术部、国家自然科学基金委和上海市科学委员会的资助,同时也得到了中国科学院上海营养与健康研究所公共技术平台和动物平台的支持。
原文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(22)00271-6
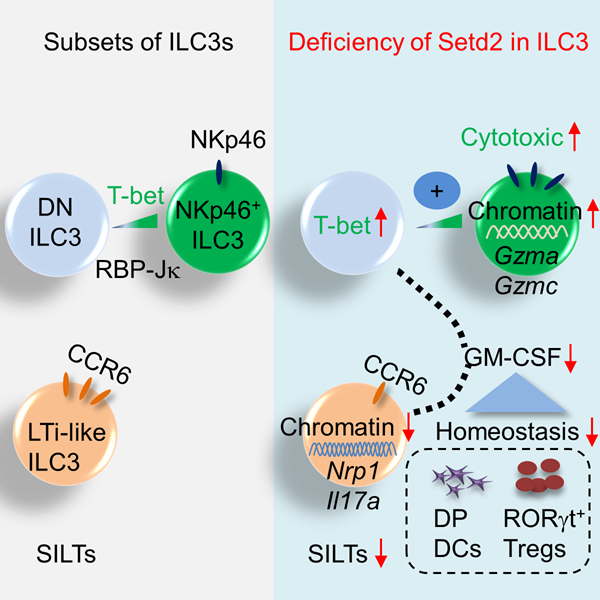 Setd2通过调控染色质开放程度而调控ILC3的各个亚群的分化和功能,进一步影响RORγt+Treg自稳态从而维持肠道的免疫稳态。
Setd2通过调控染色质开放程度而调控ILC3的各个亚群的分化和功能,进一步影响RORγt+Treg自稳态从而维持肠道的免疫稳态。






























