张磊/汤超团队构建线虫胚胎早期发育形态的可计算模型

论文题目:
Computable early Caenorhabditis elegans embryo with a phase field model
论文地址:
https://doi.org/10.1371/journal.pcbi.1009755
细胞是生命的最小活动单位。不同物种、器官、组织的细胞具有不同的形态,而形态表征了细胞的力学属性和功能。什么样的数学物理方程能够准确描述细胞形态的动力学特征,对于生物力学、细胞生物学和发育生物学都是一个重要问题。2022年1月14日,北京大学定量生物学中心/北京国际数学研究中心张磊课题组与定量生物学中心/生命科学联合中心/物理学院汤超课题组合作在《pLoS Computational Biology》期刊发表题为Computable early Caenorhabditis elegans embryo with a phase field model 的文章。该文章利用线虫胚胎形态数据构建了一个最简的相场模型,可以准确计算真实胚胎的形态变化并且反推底层的细胞力学属性,并利用该模型解析线虫胚胎的早期发育过程(图1) [1]。
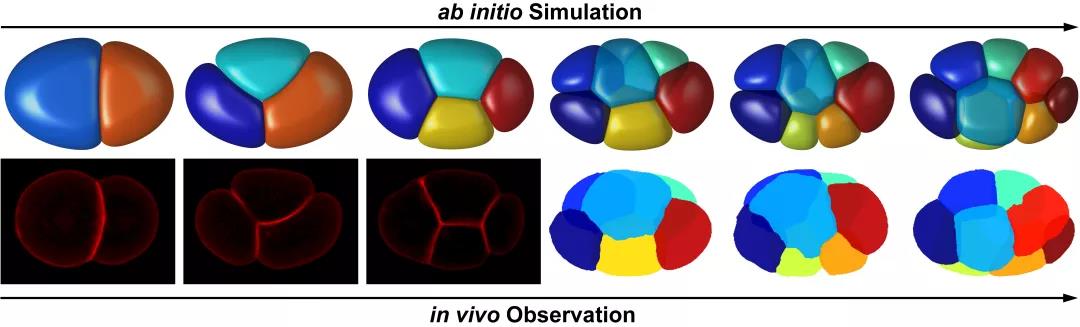
图1. 模拟计算(上)与实验拍摄(下)的线虫胚胎结构。
秀丽隐杆线虫(Caenorhabditis elegans)拥有单细胞的发育精度,即每个细胞的分裂时间、分裂方向、运动路径、命运身份等属性在不同个体间保持高度一致 [2]。由于该系统的低噪性与可重复性,从20年前至今一直有学者尝试建立不同的力学模型(比如多粒子模型与粗粒化模型)在计算机重构其形态演化过程 [3,4]。但过去的模型存在参数过多或精度过低的局限,对细胞形态、运动的细节信息(比如胞间接触面积)无法完全准确计算 [5]。
研究团队考虑细胞表面张力、细胞之间的排斥力和吸引力、细胞体积约束以及蛋壳对细胞的限制作用建立了一套相场模型。相场模型将细胞描述为受约束的可扩散场,从而刻画其形态(图2)。随后,团队利用前年绘制的线虫胚胎形态图谱简单确定模型的系统参数,并作为检验模型精准度的参考对象[6]。输入实验测得的细胞分裂次序、方向、体积比例,模型预测的1-8细胞期胚胎形态、运动与实验观察结果高度一致(图1),并重现了完整的细胞接触网络。通过对比模拟结构与实验结构,模型推断4细胞期EMS-p2细胞对与8细胞期ABpl-E细胞对存在显著低黏性,该推论近期也被实验所证实(图3)[7,8]。
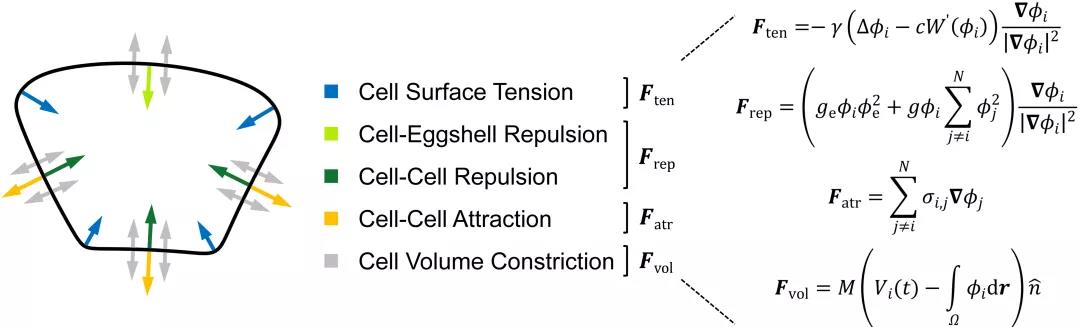
图2. 描述细胞形态与力学作用的相场模型。
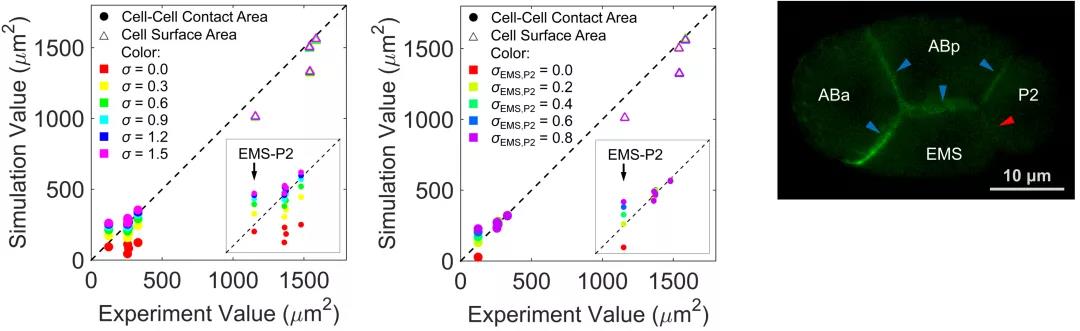
图3. 4细胞期黏性(σ为全局黏性,σEMS, p2为EMS-p2黏性)不均匀分布的理论预测。
左:拟合全局黏性;中:拟合EMS-p2细胞对黏性;右:黏性蛋白HMR-1在EMS-p2接触面分布较少。
基于上述相场模型,研究团队关注细胞分裂方向、分裂时间、黏性关系如何影响胚胎形态演化路径。其中,现实编码的分裂方向(包括不对称分裂的取向)对形态演化至关重要。及时的细胞分裂则提高了胚胎的抗压能力,有效防止细胞接触网络与胚胎结构的崩塌;胚胎受压而趋于“扁平化”的理论预测通过人工中断细胞分裂的实验得到了验证。另外,黏性关系有效地为形态演变提供多种可能的路径,而现实中观察到的ABpl-E低黏性,则是模拟中唯一一种能产生稳定、三维且正常胚胎结构的额外调控。上述模拟表明,在漫长的进化过程中,线虫发展出多种巧妙的基因程序保证其发育鲁棒性。
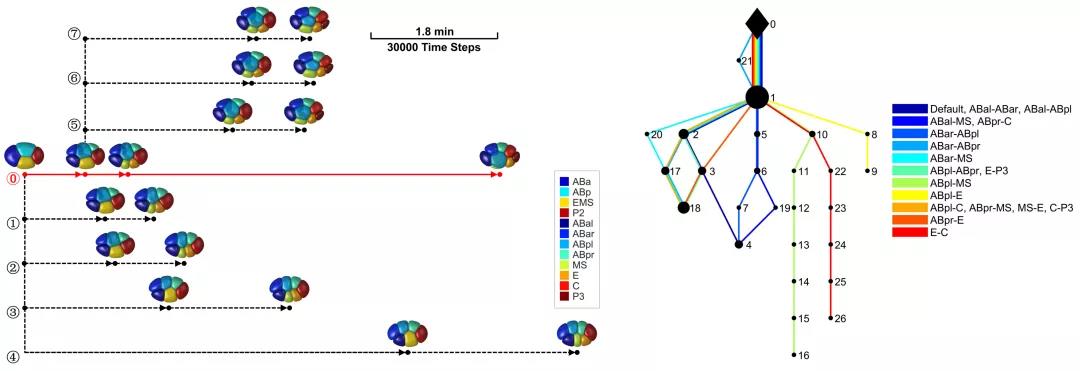
图4. 由细胞分裂时间与单一黏性调控因子所决定的发育路径树。
左:在不同时间节点上触发细胞分裂,6-8细胞期胚胎形态存在多种结果。
右:对单一细胞对进行黏性调控,8细胞期形态演变存在多种路径(ABpl-E调控是唯一稳定、抗压的路径)。
本工作提出的相场模型经过仔细的实验验证,一方面为细胞形态、力学的精准模拟提供了一种有效的计算工具;准确的模型不仅能协助我们理解现实生命系统的编码逻辑,还能应用到工程应用,比如多细胞机器人的优化设计。另一方面,利用最简模型成功计算现实胚胎形态演化并反推底层力学信息,通过寻找合适的数学物理方程,逐步构建模型并防止参数过拟合,从而更准确地理解生物的发育过程。
北京大学定量生物学中心/北京国际数学研究中心张磊副教授和定量生物学中心/生命科学联合中心/物理学院汤超教授为文章的共同通讯作者;北京大学定量生物学中心博士生匡翔宇和关国业为文章的共同第一作者;香港浸会大学生物系赵中应教授、王明健博士和Lu-Yan Chan提供了实验支持。该工作得到了国家自然科学基金委、科技部重点研发专项的资助。研究团队正致力于开发新型数据采集手段,构建数学物理模型,解析线虫等模式生物发育的基本原理。
参考文献:
[1] Kuang & Guan, et al. pLoS Comput. Biol., 2022, 18: e1009755.
[2] Sulston, et al. Dev. Biol., 1983, 100: 64-119.
[3] Kajita, et al. Genome Inform., 2002, 13: 224-232.
[4] Fickentscher et al. Biophys. J., 2013, 105: 1805-1811.
[5] Guan, et al. J. phys.: Conf. Ser., 2020, 1592: 012020.
[6] Cao & Guan & Ho, et al. Nat. Commun., 2020, 11: 6254.
[7] Yamamoto, et al. Development, 2017, 144: 4437-4449.
[8] Dutta, et al. Front. Cell Dev. Biol., 2019, 7: 209.






























