昆明植物所在百部碱催化不对称全合成研究中取得重要进展
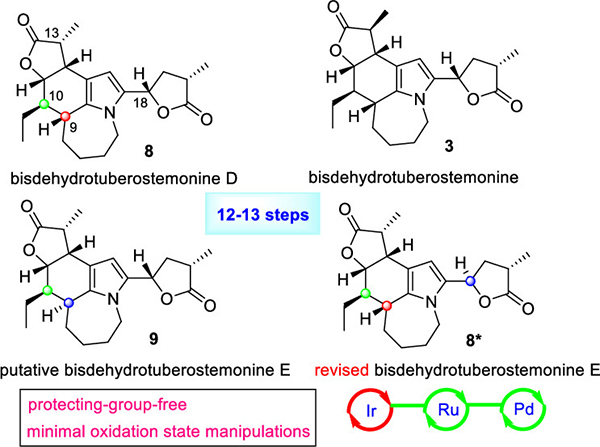
百部生物碱因其具有重要生物活性和复杂的化学结构,尤其是在多环骨架中存在许多难以控制的手性中心,成为天然产物合成中具有很大挑战性目标分子。已有百部碱全合成研究文献中,消旋体的合成研究占多数,在为数不多的不对称合成中使用手性原料(通常是氨基酸)仍为常规手段,故发展催化不对称的合成新策略新方法对解决百部碱全合成具有重要意义。Bisdehydrotuberostemonine型百部碱最早被发现于上世纪60年代,由于结构独特,除了具备百部碱多手性的合成难点外,在五环骨架中含有一个多取代的吡咯环,很大程度增加了合成挑战性。截至目前,关于此类bisdehydrotuberostemonine百部碱仅有美国著名化学家Wipf在2005年报道的一篇文献,从Cbz-L-络氨酸出发,经过27步先合成tuberostemonine中间体,再用氧化银,将tuberostemonine低效率氧化得到bisdehydrotuberostemonine,共28步,总产率0.3%完成了其全合成。
最近中国科学院昆明植物研究所天然产物合成化学团队杨玉荣课题组研究人员在近年利用铱催化烯丙基化发展出新合成方法的研究基础上(代表性方法学研究如,OL.2021,23, 1086;OL.2019,21, 2449;OL.2019,21, 840;OL.2018,20, 8035;CC.2015,51, 17471),巧妙地将Carreira的“铱/胺双元催化的醛不对称烯丙基化”和Krische的“铱催化的2-(烷氧基羰基)烯丙基化”有机结合,首次将这些先进的方法创造性地大胆运用在吡咯取代醇的不对称醛烯丙基化的立体发散合成(stereodivergent),然后对新生成的醛进行了一步高效的Krische反应,直接得到手性控制的5元内酯,为这些结构复杂生物碱的手性精准控制合成发展了新颖高效的合成策略。
作者从廉价的5-甲酰基-1H-吡咯-2-羧酸甲酯出发,三次创造性运用Ir催化不对称烯丙基化,同时结合Ru和pd过渡金属催化反应,仅用12或13步,全程无使用任何保护基,简洁高效地实现了三个bisdehydrotuberostemonine型百部碱的不对称全合成。其中bisdehydrotuberostemonine D和E为首次合成,值得注意的是,研究人员纠正此前报道的bisdehydrotuberostemonine E错误结构,并对吡咯百部碱的结构不稳定的原因进行了阐明。
杨玉荣研究组长期从事天然产物全合成研究,近年来在著名化学国际刊物JACS《美国化学会志》、ACIE《德国应用化学》和OL《有机快报》报道了多篇关于复杂生物碱全合成的重要工作(如JACS.2016,138, 2560;ACIE.2016,55, 4044;JACS.2017,139, 3364;OL.2017,19, 6460;OL.2018,20, 4575;OL.2019,21, 8485;OL.2020,22, 4489;OL.2021,23, 2731;OL.2021,23, 7972等),引起了国内外学术界的关注。
该研究成果以题为“Ir-Catalyzed Asymmetric Total Syntheses of Bisdehydrotuberostemonine D, putative Bisdehydrotuberostemonine E and Structural Revision of the Latter”在国际著名刊物JACS《美国化学会志》上在线发表,中科院昆明植物研究所研究生邓屹、梁箫副研究员和韦堃副研究员为该论文的共同第一作者,杨玉荣研究员为通讯作者。该研究工作得到国家自然科学基金面上项目(21971249和22171274),中国科学院前沿局(QYZDB-SSW-SMC026和ZDBS-LY-SM030)的资助。
文章链接






























