迎接复杂生物学问题的挑战:Chromium X高通量单细胞分析如何引领我们深入了解人类健康?
10x Genomics公司最新的单细胞仪器Chromium X提高了众多单细胞应用的通量,收获了许多新的生物学见解。现在,跟随我们来看看如何采用高通量(HT)单细胞数据来探索白血病中的稀有TCR克隆型和抗原特异性,并推动大规模综合性药物筛选技术的进步,了解高通量单细胞测序将如何打开科学发现的大门,让人们从新的角度了解疾病病理学并加速对治疗的探索。
数量就是力量
回想一下您刚进实验室的日子。您现在经常使用的技术有多少当年还没有被开发出来?在生命科学领域,各种方法的发展速度让人惊叹,但当我们考虑到这些技术的进步也是在努力追赶某个领域不断增长的需求时,这种高速发展似乎是不可避免的——新的研究往往会提出更复杂的问题,对新方法的需求也就应运而生。单细胞技术正是这样一种进步,在过去十年间实现了令人难以置信的增长,因为研究人员发现了大量信息,而这些信息只有在单细胞分辨率下探索生物学才能获得。
随着单细胞研究的流行不断扩展到与人类健康和疾病相关的各种基本问题,这些研究的范围和规模也在扩大。2020年一项对单细胞转录组学出版物的调查显示出了大规模实验的明显趋势(1)。随着文章发表率的稳步提高,分析的细胞数量也在增加。
作者指出,“单个研究项目的规模随时间而不断扩大,每隔几个月就会发布一项新研究,在分析的细胞数量上又打破了之前的记录。在2020年上半年,每个月大约有140万个细胞被添加到公共数据库中。”
在深入分析这些文献结果后发现,鉴定出的细胞类型数目与研究的细胞数量密切相关。简而言之,细胞更多则意味着数据更多,定义细胞亚群的能力就会得到改进,并且能够检测到更多不同的细胞簇和稀有细胞类型,所有这一切都有助于更好地了解该样本的内在生物学。
对复杂的生物系统进行有意义的探索,通常需要大规模的单细胞研究。对数十万个细胞进行分析能够实现患者队列的研究、特定器官的深度分析以及比较健康和患病组织的转化研究。将实验规模扩大到百万细胞级别将促进全面的细胞图谱分析、高通量的药物和CRISpR筛选以及深度的免疫组库分析。
这些要求极高的研究目标长期以来一直是挑战。由于缺乏简化的流程,且研究数十万至数百万个细胞的成本太高,这种宏大的细胞数量很难达到。我们最新的单细胞平台Chromium X提供了可靠且可扩展的方法,不仅能够让这些类型的研究触手可及,而且能使其变得常规。在下文中,我们将介绍一些重点研究,包括对白血病中的TCR-抗原特异性和稀有克隆型的研究,以及肺癌细胞系中药物应答机制的全面表征。
扩大研究规模以应对TCR组库的多样性
癌症是一个难以应付的对手,天生适应性强,且组成复杂。T细胞幼淋巴细胞白血病(T-pLL)是一种高度侵袭性的癌症,其特征是成熟T细胞生长失控。不幸的是,绝大多数T-pLL患者在采用标准疗法后都无法达到长期缓解,这使得开发新疗法以改善临床结局变得至关重要。TCR组库有着惊人的多样性,这为发现临床相关见解带来了巨大潜力,而揭示隐藏在其中的细节更有望为新型免疫疗法的开发提供方向(2)。我们采用Chromium单细胞免疫分析HT试剂盒以及Feature Barcode技术,分析了一名T-pLL患者骨髓穿刺物中的TCR克隆型和抗原特异性。
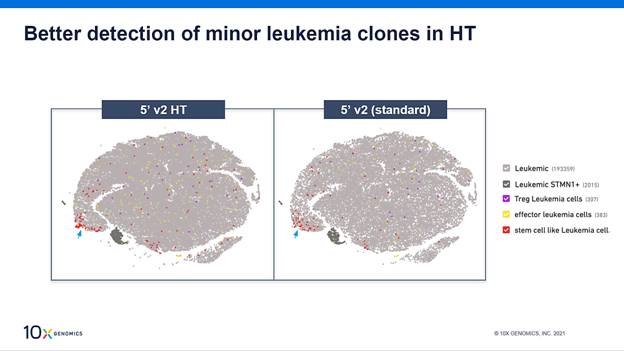
通过标准通量和高通量Chromium单细胞免疫分析来检测白血病的稀有克隆
我们并行开展了HT分析和标准分析,以便直接比较通量差异对鉴定稀有细胞类型的能力有何影响。尽管这两种试剂盒都能鉴定出所有白血病亚群,但HT试剂盒由于通量更高,能够更好地检测稀有克隆,包括图中以红色显示的干细胞样克隆。
根据标准通量和高通量Chromium单细胞免疫分析的数据,查看EB病毒(EBV)抗原结合的置信度
采用一组共27种dextramer试剂对T-pLL样本进行染色,包括对照、病毒和癌症抗原。仅检测到7个抗原具有较高的UMI计数中位数和抗原特异性证据。其中有4个是与HLA匹配的:包括两个癌症抗原和两个病毒抗原。我们深入研究了其中一种病毒抗原EBV,以评估抗原结合的置信度。若一个克隆型内的多个细胞被多次观察到与相同的抗原结合,则结合分配的置信度会增加。如上图所示,高通量分析提供的数据能够在抗原特异性的克隆型内观察到更多细胞,提高结合置信度,并证明对稀有的抗原特异性TCR序列有更好的筛选。
通过高通量筛选从多角度了解药物发现
药物发现是一个既费时又费力的过程,疾病很复杂,对药物治疗的应答各有不同。后期失败是很常见的,这使得药物开发的旅程往往让人沮丧。即使是成功的候选药物也要花费数亿美元和平均七年时间才能进入市场(3,4)。高通量筛选(HTS)能够测试大型的候选药物化合物库,但在大多数情况下,分析只是一维的,提供单一读数,比如后期时间点的细胞形态或单个荧光基因活性。关于药物活性或作用机制,这些有限的数据无疑只能提供极少的信息。单细胞高通量筛选分析有望构建一幅更完整的图像,反映细胞通路如何受到候选药物的影响。通过大规模收集内容丰富的单细胞数据,科学家能够查询多种疗法、时间点和/或细胞群。这种更全面的筛选能够在药物开发流程的早期更好地表征疗法的影响。
我们应用此原理来检测两种非小细胞肺癌(NSCLC)细胞系对药物的反应:H1975和A549。在低通量(LT)实验中,我们使用Chromium单细胞基因表达LT试剂盒来测试最佳实验条件,包括样本制备、药物浓度和治疗时间。每个Chromium单细胞分析都采用相同的试剂和流程,以实现从初步研究到完整HT研究的平稳过渡。H1975和A549分别用四种不同的药物处理,其中一些是不同药物的组合,因此每个细胞系共接受8种不同的药物处理。在处理后4、16和24小时收集已处理和未处理的样本。Cellplex技术在这里进一步帮助扩展了筛选能力,使我们能够以适当的规模开展药物筛选分析,最后我们从525,251个细胞中收集了药物活性、疗效和作用模式的数据。
H1975在8种药物处理和3个时间点下的UMAp图像的3D动画
对于H1975细胞系,克唑替尼(crizotinib)和奥希替尼(osimertinib)这两种单一药物处理在16小时后有效下调了细胞周期标志物CDK2,并在24小时后达到与厄洛替尼(erlotinib)联合处理相同程度的下调。选择克唑替尼来进一步分析驱动这种作用的生物学机制。
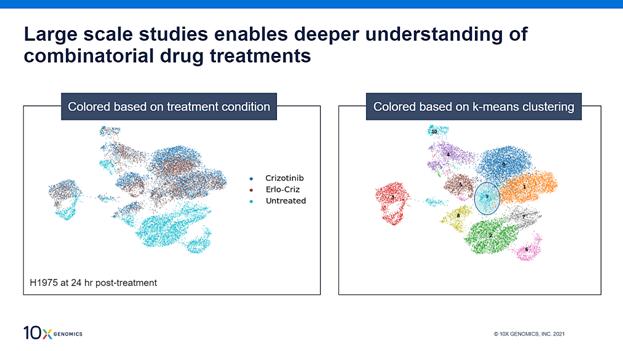
单独使用克唑替尼或联合使用厄洛替尼处理H1975细胞24小时后的聚类分析
我们对三个处理组开展了进一步的细胞聚类分析:未处理的对照组、单独使用克唑替尼组和联合使用厄洛替尼组(erlo-criz)。HT数据的UMAp投影(上图)展示了三种条件下11个不同的细胞簇,而克唑替尼组的大多数细胞与联合处理组(erlo-criz)重叠。9号细胞簇脱颖而出,其中erlo-criz处理后的细胞数量是克唑替尼处理后的两倍,表明对联合处理的反应比其他细胞簇更强。
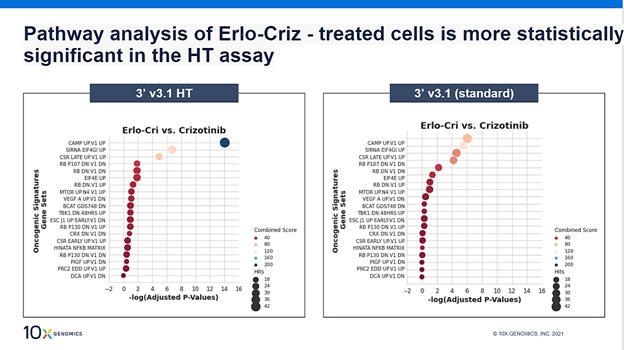
对排名前1,000位的基因进行基因集富集分析(GSEA),这个排名是根据文献以及对细胞周期通路中
基因功能的共识来确定的。图中显示了标准分析和HT分析的数据点状图。
在进一步分析9号细胞簇的基因表达谱后发现,大多数上调基因与线粒体相关,指向了细胞应激。基因集富集分析(GSEA;上图)显示,调控细胞周期、生长和增殖的cAMp通路显著富集。这表明细胞周期基因下调的的机制是通过cAMp通路起作用。我们还用标准的Chromium单细胞分析开展了同一实验,发现尽管通路分析具有可比性,但HT带来的更高细胞通量确实提高了分析的统计能力。
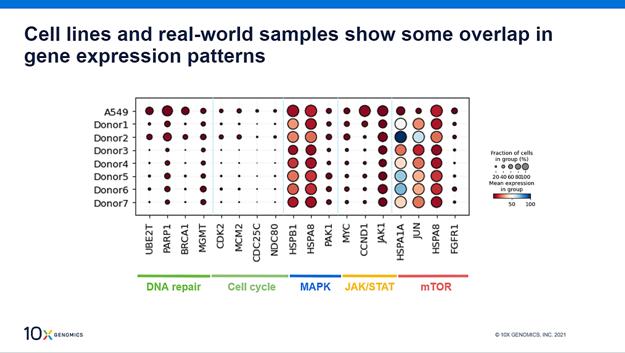
让我们再花点时间来看看A549细胞系,它携带KRAS突变,用于本实验的初始阶段。值得注意的是,一项早期的独立研究对7例原发性NSCLC患者的样本进行药物筛选分析,这些样本混合在一起,其中大多数也包含KRAS突变。问题自然出现了:A549细胞系与患者样本在基因特征方面相比如何?
通过点状图来分析患者样本和A549细胞系在经过药物处理后的基因特征
借助目前的两个HT数据集,我们发现细胞系与真实样本之间的不同特征和信号重叠,这表明A549细胞可用于大规模的药物筛选,为携带KRAS突变的NSCLC确定更有效的新靶点。
为实验带来新的可能性
我们很高兴看到高通量单细胞应用能够引领研究走向何方,以及它如何改变我们对人类健康和疾病的了解。这几个例子只是冰山一角,随着新见解的出现,更多的问题必将接踵而至。过去的种种迹象已经表明,技术只会不断地进步,以满足客户越发雄心勃勃的需求。
这正是Chromium X的用途所在,它利用久经考验的化学方法和更高的通量来不断扩大实验的可能性,让研究人员能够更好地回答与人类健康和疾病的内在机制相关的重要问题。通过这些强大的流程,科学家能够经济高效地扩展他们的实验,同时保持着与标准分析相同的灵敏度和多组学数据输出。
如果您错过了我们的Chromium X网络研讨会,欢迎观看本系列研讨会的回放视频,仔细查看这些数据集并感受Chromium X的强大功能。
参考文献:
1. Svensson V, et al. A curated database reveals trends in single-cell transcriptomics. Database 2020, baaa073 (2020).
2. Carter JA, et al. Single T Cell Sequencing Demonstrates the Functional Role of αβ TCR pairing in Cell Lineage and Antigen Specificity. Front Immunol 10:1516 (2019).
3. prasad V, Mailankody S. Research and Development Spending to Bring a Single Cancer Drug to Market and Revenues After Approval. JAMA Intern Med 177(11):1569 (2017).
4. Wouters OJ, McKee M, Luyten J. Estimated Research and Development Investment Needed to Bring a New Medicine to Market, 2009-2018. JAMA 323(9):844 (2020).