西湖大学研究团队发表两项最新研究成果
近期,西湖大学有哪些科研新成果?
西湖大学王怀民研究团队在Angewandte Chemie-International Edition期刊发表了题为“Spatiotemporal Control over Chemical Assembly in Living Cells by Integration of Acid-Catalyzed Hydrolysis and Enzymatic Reactions”的研究论文,使用设计的多肽分子,通过控制多肽分子组装的形式,实现了功能多肽分子在细胞内的可控聚合。王怀民博士为本文的通讯作者,杨雪娇博士为第一作者,西湖大学为第一和通讯单位。
西湖大学生命科学学院李旭、马仙珏、吴连锋课题组与加州大学Irvine分校Wenqi Wang课题组、MD Anderson癌症中心Junjie Chen课题组合作,在Developmental Cell杂志上以长文形式发表了题为Low-density Lipoprotein Receptor-related protein 1 Mediates Notch pathway Activation的研究论文。该工作首次建立了人类Notch信号通路蛋白互作网络,发现了Notch通路的关键上游调控因子LRp1,并揭示了靶向LRp1的药物未来可能用于Notch通路异常激活的癌症的治疗。西湖大学生命科学学院卞维祥、江华、许纹衍、郝婉钰、岁月,以及MD Anderson癌症中心Mengfan Tang为论文的共同第一作者。西湖大学生命科学学院李旭、马仙珏、吴连锋,MD Anderson癌症中心Junjie Chen,以及UC Irvine分校Wenqi Wang为论文的共同通讯作者。
西湖大学王怀民研究团队引入化学分子刹车片,精确控制多肽在活细胞内聚合
细胞是组成人体的基本活性单元,细胞通过合成多种物质(如蛋白质、核酸、脂质分子等)来维持人体的稳态。人体能一直保持健康状态,是因为细胞合成这些物质是精确可控并且能随着疾病环境来进行相应的调控,当这种调控处于失衡状态,人类就会被各种各样疾病困扰。各学科科学家在对疾病产生机理和治疗探索方面都做出了很大的贡献。随着对细胞精确控制物质合成的理解越来越深入,人为设计和合成化学分子并控制其在细胞里原位合成功能物质就显得越来越重要,这是因为人为调控化学分子在细胞里的行为对了解疾病产生和治疗、甚至是生命起源都有很大借鉴意义。然而要在复杂的活细胞里人为精确控制化学分子的合成聚合具有非常大的挑战:一方面,化学分子进入细胞时,如何避免与细胞内多种组分相互作用?另一方面,化学分子如何才能进入到细胞某个特定部位并形成功能物质?近日王怀民团队在这方面取得了系列进展。
王怀民研究团队使用设计的多肽分子,通过控制多肽分子组装的形式,实现了功能多肽分子在细胞内的可控聚合。他们使用的一种策略为诱导自组装。简单来讲,自组装类似垒积木或者组装变形金刚的过程:把一块块积木(基本单元)按照一定的方式组合起来,变成有功能的(如房子结构)结构,发挥人们想要的作用(比如住房)。然而,垒积木是有图纸可循,即按照加工好的模块一块块拼接,诱导组装要比这难很多。首先要根据想象的功能结构,人为设计合成化学分子,化学分子继而通过特定条件诱导和识别,才能最终组装成特定的功能结构。
如下图所示,该研究团队通过化学方法,在分子水平上对多肽分子进行翻译后修饰的调控,给酶特异性底物分子装上分子刹车片,利用细胞溶酶体内特有的酸性环境调控分子刹车片,构建了一种全新的多肽多层级组装策略,在活细胞中实现分子水平控制多肽功能结构的原位形成,进而为实现人工精准合成细胞内新物质提供了一种新策略(图1)。
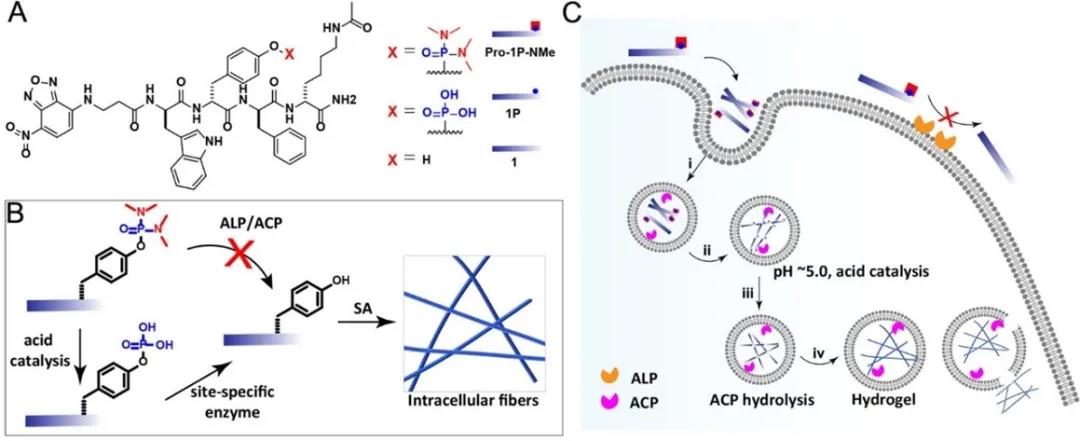
图1. A) 多肽分子的化学结构式;含有刹车片的多肽分子在B) 体外和C) 细胞内发生酸解和酶促组装示意图。
首先,作者在荧光多肽分子上引入双(二甲基氨基)磷酸,在双(二甲基氨基)的保护下,多肽分子不会发生酶解。只有在酸性条件下,p-N键会发生断裂,暴露出酶促反应底物。进一步,在酸性磷酸酶(ACp)的作用下,多肽分子会进一步发生酶解,形成自组装多肽。冷冻电镜(Bio-TEM)图片证明,酸催化水解及酶促组装的进行可以促进纳米纤维的形成。
将双(二甲基氨基)保护和磷酸基团修饰的多肽分子与人成骨肉瘤细胞(Saos-2)和前列腺癌细胞(pC-3)共孵育,激光共聚焦显微镜(CLSM)观察发现,不带刹车片的磷酸修饰的多肽分子会在细胞膜表面发生聚集,产生绿色荧光(图2);而带有刹车片的双(二甲基氨基)保护的分子则会通过巨胞饮作用进入细胞,在溶酶体中产生绿色荧光。对细胞裂解液进行分析,带有刹车片的多肽分子确实在溶酶体中发生了酸解和酶解。
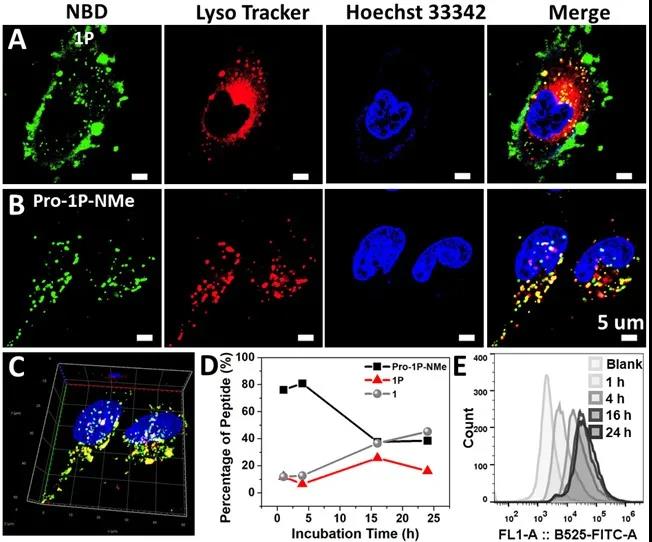
图2. A) 不含有和B, C) 含有刹车片的多肽分子与Saos-2细胞共孵育4 h的CLSM图片;D) 水解和酶解产物含量随孵育时间变化图;E) 含有刹车片的多肽分子与Saos-2细胞共孵育不同时间的荧光强度图。
该工作首次提出通过分子刹车片控制化学分子在体内的可控精准组装,整合了酸催化水解和酶诱导自组装,实现了在活细胞中特定细胞器发生分子自组装。基于该工作,该研究团队指出控制多肽分子在细胞内发生组装需要满足下面几个条件:1)设计的多肽分子衍生物需要具备抗酶解特性,保证其在细胞质或细胞膜上不被酶解;2)多肽分子衍生物在细胞内需要发生化学反应,暴露出组装序列;3)组装序列可以在特定部位中富集,形成有序结构。该研究的发现为活细胞内精准合成功能性的多肽材料和药物提供了一种新策略,也为多肽材料用于蛋白和核酸的可控递送提供了新的方法。例如,以前是在外面合成药物,药物化学合成候选物之后,首先在细胞和动物水平上筛选,然后再在人体去筛选。像平时吃的感冒药,都是外面合成的药物。该研究团队的成果为直接在体内原位合成药物提供了一种可行的策略:本来药物都是小的片段分子,那么细胞把这些片段分子都吞进去之后,它自己去组装起来,比如说让癌细胞去吞,癌细胞吞完之后,它自己在体内原位合成药物,那它就只对癌细胞有毒,对正常细胞没有毒,这等于合成组装一种可编程系统(图3)。
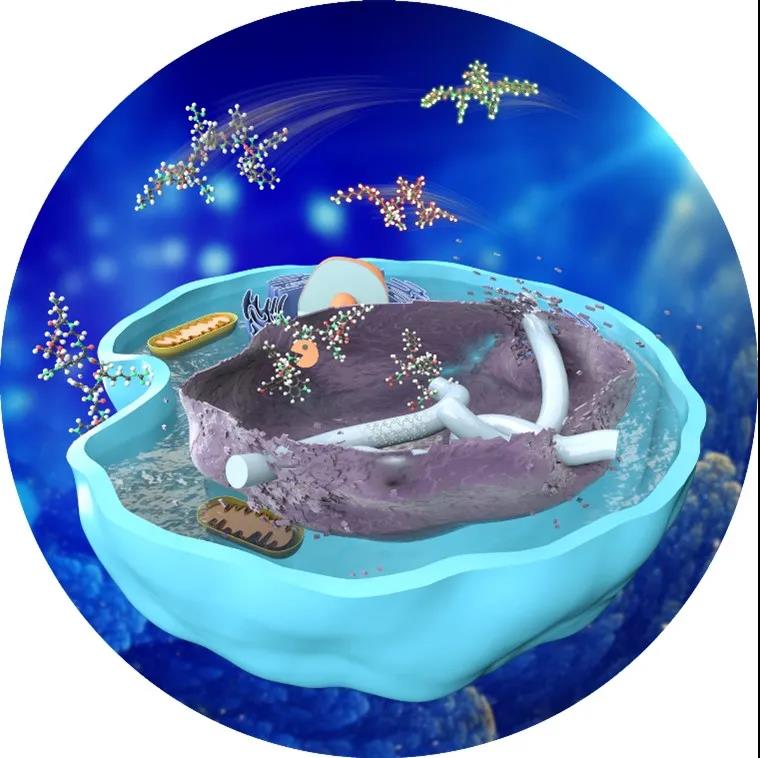
图3. 细胞内原位组装具有抗癌活性物质示意图
引用文献:
[1] Yang, X., Lu, H., Tao, Y., Zhou, L., and Wang, H.* Angew. Chem. Int. Ed. Engl., (2021).doi.org/10.1002/anie.202109729 (hot paper)
[2] Hu, L., Li, Y.,?Lin. X.,?Huo, X., Zhang, H., and Wang, H* Angew. Chem. Int. Ed. Engl., (2021). doi.org/10.1002/anie.202103507(hot paper)
论文原文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202109729
西湖大学李旭、马仙珏、吴连锋等团队合作建立人类Notch信号通路蛋白互作网络
Notch是一种广泛存在于多种物种中的基因,一百多年前,科学家们在果蝇中发现了Notch基因,这种基因的缺失会导致果蝇翅膀上存在V型缺刻(Notch),因此这种基因被命名为Notch基因。在秀丽隐杆线虫、果蝇到哺乳动物的多种物种中,Notch信号通路十分相似且不易变化,是发育过程中最重要的信号通路之一。Notch信号决定了细胞的命运,影响着器官的发育,在凋亡、分化和迁移的调控中起着核心作用。一旦Notch通路发生异常,会导致包括发育异常、阿尔茨海默病、先天性心脏病和血液系统癌症等复杂疾病的产生。
Notch信号的传导并非是简单的线性传递,而是由复杂的蛋白质网络构成,然而,目前我们对Notch信号通路蛋白质网络的构成和调节知之甚少。系统建立并研究Notch信号通路的蛋白相互作用网络,对于阐明这一重要信号通路实现精准调控,揭示新的重要药物靶点具有重要意义,并且可以对未来治疗Notch信号通路相关的遗传病及复杂疾病提供方向。
2021年10月8日,西湖大学生命科学学院李旭、马仙珏、吴连锋课题组与加州大学Irvine分校Wenqi Wang课题组、MD Anderson癌症中心Junjie Chen课题组合作,在Developmental Cell杂志上以长文形式发表了题为Low-density Lipoprotein Receptor-related protein 1 Mediates Notch pathway Activation的研究论文。该工作首次建立了人类Notch信号通路蛋白互作网络,发现了Notch通路的关键上游调控因子LRp1,并揭示了靶向LRp1的药物未来可能用于Notch通路异常激活的癌症的治疗。

论文截图
原文链接:https://www.cell.com/developmental-cell/fulltext/S1534-5807(21)00733-4
研究团队首先利用功能蛋白质组学手段建立了人类Notch信号通路的蛋白互作网络,极大地拓展了目前对于Notch信号通路的认知。通过将Notch通路蛋白互作网络与多个人类疾病相关的数据库整合,研究团队发现Low-density Lipoprotein Receptor-related protein 1 (LRp1)可能是Notch信号通路重要的调控因子。
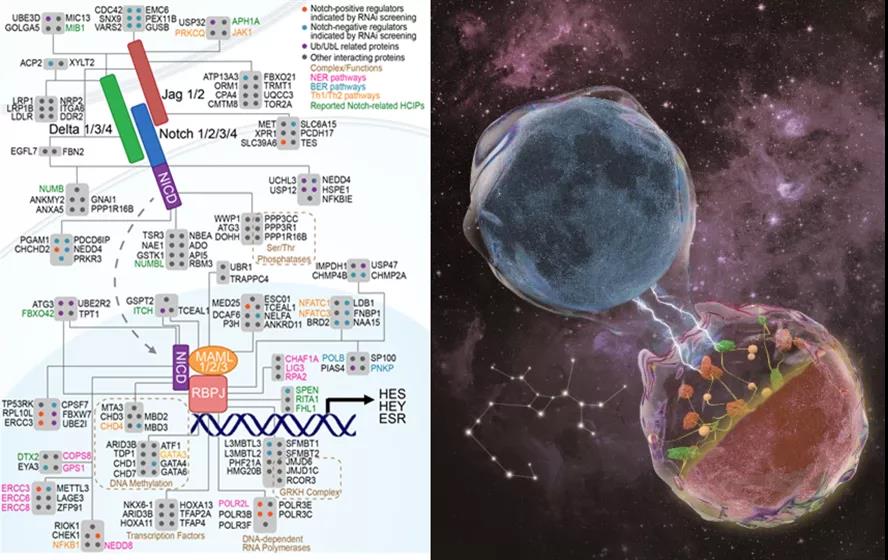
(左)Notch信号通路蛋白互作网络中的重要蛋白及相关功能。(右)人类Notch信号通路蛋白质互作网络:两个星球(细胞)间的闪电(Notch通路配体受体结合)引发了星球上分子(蛋白质)的结合,创造了生命(下游信号),并在浩瀚的宇宙间引发了回响(整个系统的生理及病理变化)。
随后,研究团队进行了一系列生化及细胞实验,证实了LRp1是Notch通路的一个关键上游调控因子。LRp1通过与Notch配体Delta相互作用,影响其与E3泛素连接酶的结合,进而参与Notch配体Delta泛素化链型的改变,从而介导Delta的内吞循环、膜定位和稳定性。为了进一步证明LRp1在Notch信号通路中的重要性,研究团队利用秀丽隐杆线虫及果蝇这两种模式生物,对LRp1的功能进行深入探究,并证实了LRp1参与Notch通路的活化。最后,为了确定LRp1在病理条件下的生物学意义,研究者构建了小鼠异种移植瘤和尾静脉注射的T-ALL模型,并发现敲除LRp1可显著抑制白血病细胞迁移、侵袭和肿瘤发生。使用LRp1的拮抗剂RApm6可以有效抑制Notch信号的激活,并显著减缓肿瘤发展。该文解析了生命活动中至关重要的Notch信号通路,并为未来临床介入治疗相关癌症提供了无限可能。
西湖大学生命科学学院卞维祥、江华、许纹衍、郝婉钰、岁月,以及MD Anderson癌症中心Mengfan Tang为论文的共同第一作者。西湖大学生命科学学院李旭、马仙珏、吴连锋,MD Anderson癌症中心Junjie Chen,以及UC Irvine分校Wenqi Wang为论文的共同通讯作者。






























