贺福初/丁琛团队《Science Advances》报道精密解析染色质开放区域蛋白质-DNA转录机器的“工具包”
转录调控蛋白质机器由转录因子(transcirption factor,TF)、转录辅助因子(transcirptional coregulator,TC)等构成,其在几乎所有生物学进程(如分化、发育、细胞周期控制和细胞凋亡等)中都发挥着关键作用。基因的转录过程依赖于转录调控蛋白质机器与DNA结合并行使相应功能,二者的结合是基因启动转录的前提。真核生物基因组中的染色质有一些区域经染色质重塑后呈现出松散的状态,这部分DNA区域被称为开放染色质(open chromatin)或可接近性染色质(accessible chromatin),而染色质是否呈疏松结构,是蛋白质机器与DNA是否互作的关键因素之一。
在基因组层面,2013年,斯坦福大学的Howard Chang教授开发了ATAC-seq技术(Assay for Transposase-Accessible Chromatin with highthroughput sequencing),可以通过高通量测序获得染色质开放区和基因组中活跃转录的调控序列的关键信息。而在蛋白质组水平,由于转录因子和转录共调节因子表达丰度低且缺乏相关富集技术,科学界仍然难以对上述蛋白分子与染色质开放区的结合配对关系进行全景式的精细解析。
2021年10月22日,我院贺福初/丁琛团队在Science Advances在线发表了题为proteome-wide profiling of transcriptional machinery on accessible chromatin with biotinylated transposons的有关蛋白质-DNA转录机器的最新研究成果。该成果显示,复旦大学团队在世界范围内首次实现了染色质开放区转录蛋白机器的鉴定及功能研究。

多年来,贺福初/丁琛团队,聚焦这一难题持续开展科研攻关。早在2013年,丁琛/秦钧团队开发catTFRE技术,首次设计合成了串联各种转录因子的多拷贝双链DNA结合元件,从核蛋白中富集具有DNA结合活性的内源转录因子及其复合物,对开展转录调控具有重大价值。
在本次发表的最新成果中,科研人员基于ATAC-seq技术,开发出直接富集和定量内源性染色质开放区域实时原位转录的转录蛋白机器的新方法ATAC-MS(图1)。该技术利用生物素化的高活性Tn5转座子,特异性结合染色质开放区暴露的DNA,将DNA片段化并进行生物素(biotin)标记。而后通过链霉亲和素偶联的磁珠与生物素化的DNA反应,分离纯化出DNA及DNA上结合的转录复合物。对上述复合物分别进行蛋白质酶解-肽段纯化与DNA纯化-文库构建,可用于平行的质谱鉴定与二代测序分析,由此可直接观测获得转录调控蛋白质机器信息及其结合序列motif信息。
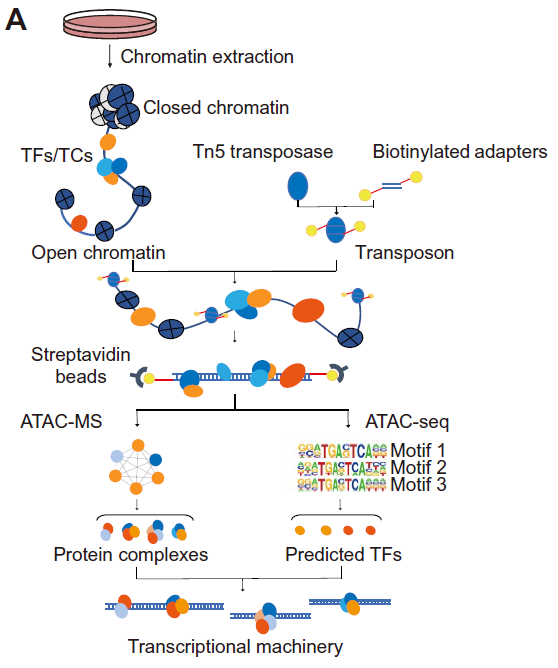
图1. ATAC-MS原理示意图
该方法在使用低至5×105的细胞量时,便可对转录因子和转录共调控因子的鉴定有着较好的灵敏性和特异性(图2)。与ATAC-seq检测到转录因子结合序列不同,ATAC-MS可以直接捕获转录因子(TF)及与之共同作用的转录复合物。
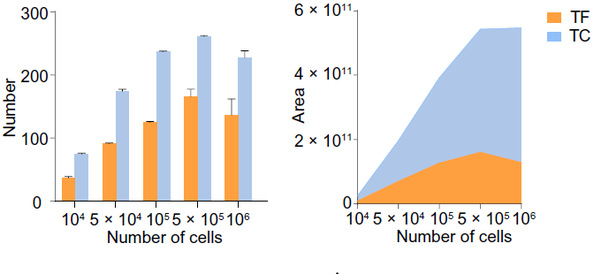
图2. ATAC-MS对TF、TC的检测灵敏度检测
使用肿瘤坏死因子(TNF-α)对HeLa细胞进行刺激后,ATAC-MS成功鉴定到转录因子NFKB家族及与其相互作用的TFs的变化(图3)。此外,使用雌激素受体17β雌二醇(E2)及其拮抗物4-羟基他莫昔芬(4-Hydroxytamoxifen)刺激MCF7细胞时,ATAC-MS不仅能检测到核心转录因子ESR1的变化,还能观测到E2的刺激导致与ESR1共同作用转录共激活因子(coactivator),如NCOA3,Ep300等的富集。而在4-HT的刺激下,转录共抑制因子(corepressor)如NCOR1, HDAC2等也可被ATAC-MS成功捕获。这证实了对于转录共调节因子的高富集能力是ATAC-MS技术的优势。
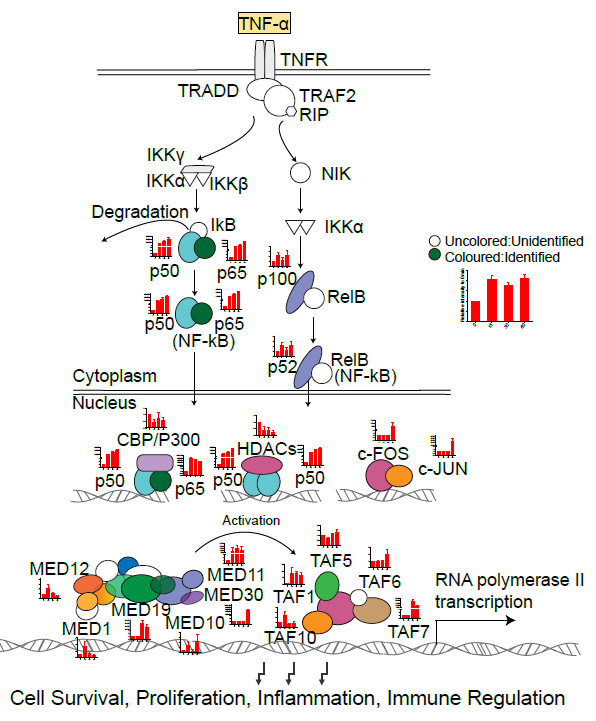
图3. ATAC-MS检测TNF-α刺激应答转录因子复合物
进一步的,该团队将ATAC-MS技术与阴离子交换技术结合,开发出高分辨率ATAC-MS解析技术(fractionation ATAC-MS,fATAC-MS)。利用不同浓度盐溶液洗脱,将DNA-转录机器复合物分成不同组分,降低复杂度,提供更高分辨率的转录蛋白-DNA图谱。实验显示,不同组分中的共洗脱蛋白质/DNA成分显示出特征性的功能和特征性的DNA结合基序。一些具有保守功能的蛋白质复合物,如RNA聚合酶II相关蛋白和染色质修饰酶(HDACs等)在所有组分中被广泛洗脱和鉴定。这些发现显示了fATAC-MS在全基因组范围内进行高分辨率蛋白质机器-DNA互作关系解析的应用潜能。这展示了ATAC-MS可用于在全基因组水平绘制蛋白质-DNA转录调控复合物图谱。
进一步的,作者设计并表达了一种新型Tn5-dCas9融合蛋白,将ATAC-MS升级为具有靶向性的ctATAC-MS(dCas9 targeted ATAC-MS)。在没有sgRNA的情况下,Tn5-dCas9融合蛋白作为Tn5转座子与开放染色质结合,由此可用于全基因组水平的转录调控蛋白质机器;而在有sgRNA的指导下,Tn5-dCas9对特定靶向的DNA序列具有亲和力,可精确揭示特定位点的转录调控蛋白质复合物。升级的ctATAC-MS方法系统地描述了在小鼠肝脏昼夜节律时钟中靶向E-box的转录过程,揭示了不同转录因子在昼夜节律中的潜在机制。
综上,贺福初/丁琛团队本次发表的研究提供了一个包括3种全新方法——ATAC-MS、fATAC-MS和ctATAC-MS在内的转录调控复合物解析“工具包”,使得我们既能够在全基因组层面绘制活跃的转录调控蛋白质机器图谱,也可以在特定基因组位点上探究蛋白质-DNA转录调控复合物。该工具包将使该领域的研究人员能够深入挖掘不同层次的转调控机制,并具有兼顾体内/体外反应的特点,在临床活检、多种组织标本检测和不同物种检验等领域具有广泛的应用潜能。
该研究得到上海市市级科技重大专项“国际人类表型组计划(一期)”的支持。复旦大学生物医学研究院2017级博士生张海珠、复旦大学人类表型组研究院副研究员秦兆宇、复旦大学生物医学研究院2018级博士生岳雪彤为本文共同第一作者。上海交通大学医学院附属新华医院杨雯隽研究员,中国科学院院士、遗传工程国家重点实验室和复旦大学生物医学研究院特聘pI及人类表型组研究院特聘导师贺福初教授,复旦大学人类表型组研究院副院长、遗传工程国家重点实验室、生命科学学院及生物医学研究院丁琛研究员为该论文的共同通讯作者。
论文链接:https://doi.org/10.1126/sciadv.abh1022






























