肝脏p38激活通过FGF21调控机体代谢的分子机制
2021年10月21日,中国科学院上海营养与健康研究所应浩研究组联合复旦大学附属中山医院的蒋晶晶研究团队在Diabetes期刊在线发表了标题为“Hepatic p38 Activation Modulates Systemic Metabolism Through Fgf21-Mediated Interorgan Communication”的研究成果。该研究发现肝脏p38激活是肝脏脂肪变性的驱动因素,而肝脏FGF21表达和分泌的增加及其受体辅因子β-Klotho(KLB)表达的下调,在肝脏p38激活诱导脂肪肝形成过程中起重要作用。这项研究为寻找非酒精性脂肪肝(NAFLD)的发病机制提供了新的线索。
NAFLD是肥胖的常见并发症,已成为当前全球重要的公共健康问题之一。虽然多种模型表明遗传、生理和环境因素参与调控肝脏脂质代谢和肝脏脂肪变性的发生发展,但肝脏脂质堆积的机制仍然需要更深入的研究。既往研究表明,无论是在饥饿还是在遗传或饮食诱导的脂肪肝小鼠模型中,肝脏中p38的磷酸化水平显著上升,然而p38的激活是肝脏脂质堆积的原因还是结果尚不清楚。FGF21是新型的内分泌激素,主要由肝脏分泌,对机体多个组织有重要的代谢调控作用。FGF21类似物对多种代谢性疾病都有潜在的应用前景。FGF21是NAFLD的血清标志物,患者血清的FGF21水平显著升高,肝脏FGF21表达增加。以往的研究还提示,NAFLD动物模型的多个组织存在FGF21抵抗。但FGF21的生理功能及其在NAFLD的发生发展过程中的作用和相关病理生理机制并不清楚。
研究团队首先利用MKK6腺病毒在小鼠肝脏中激活p38,发现肝脏p38的激活能够造成严重的脂肪肝,并伴随肝脏脂质代谢异常、脂肪组织重量减少、血清中脂肪酸水平增加、外周组织胰岛素敏感性增加。有意思的是,在肝原代细胞上则观察不到p38激活对肝脏脂质代谢的影响,这提示肝脏p38激活诱导肝脏的脂质堆积可能涉及组织互作机制。利用肝脏特异p38α敲除小鼠,发现肝脏MKK6过表达所引起的代谢效应完全依赖于肝脏p38α。
研究团队发现MKK6过表达诱导的p38激活可以通过XBp1调控肝脏FGF21的表达和分泌,从而促进脂肪组织的水解,血清脂肪酸水平的增加。肝脏特异性p38α敲除可以完全消除肝脏MKK6过表达对FGF21表达和分泌的调控作用。此外,利用FGF21肝脏敲减小鼠,发现由MKK6过表达诱导的p38激活所造成的肝脏脂质堆积和其他代谢变化,也完全依赖于肝脏FGF21。进一步研究发现,p38激活能够促进KLB的泛素化和降解,导致KLB蛋白水平下降,造成肝脏FGF21抵抗,进而促进脂质过度积累。
综上,该研究发现肝脏p38信号持续激活,一方面将促进肝脏FGF21表达和分泌,加快脂肪组织动员,导致大量脂肪酸进入肝脏,并通过底物推动机制促进脂质在肝脏的异位沉积;另一方面通过下调KLB,抑制FGF21在肝脏中作用,造成肝脏FGF21抵抗,进而促进脂肪肝的形成。该项研究提供了肝脏p38和肝脏FGF21通过组织间的相互作用调控机体代谢的生理学和遗传学证据,提高了对NAFLD的发病机理的认识水平,对理解非肥胖性脂肪肝的病理生理也有借鉴作用。
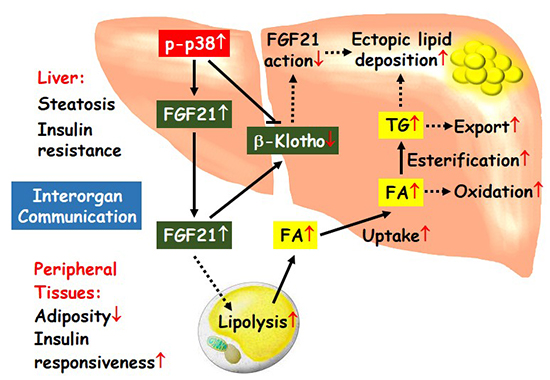
图:肝脏p38通过调控FGF21影响机体代谢
中国科学院上海营养与健康研究所应浩研究员和复旦大学附属医院中山医院副主任医师蒋晶晶为本文的通讯作者,中国科学院上海营养与健康研究所博士刘威、孙超、博士研究生颜莹为该论文的第一作者。该研究得到了国家自然科学基金委员会及科技部等项目的资助,同时也得到了中国科学院上海营养与健康研究所公共技术平台和动物平台的支持。
原文链接:https://doi.org/10.2337/db21-0240






























