附属新华医院李斐教授团队参与发表关于高功能自闭症基因致病机理的研究成果

儿童自闭症(又称孤独症)是一类童年起病、以行为异常作为主要诊断依据的神经发育障碍,核心症状主要表现为不同程度的人际交往障碍、兴趣狭窄和行为方式刻板,发病率高(1-2%),是严重的社会和公共卫生问题。据中国残联数据显示,我国有超过1000万自闭症人群,并以每年10%速度递增。自闭症由于病因不清,早期诊断和干预困难,大部分终生残疾,被Science杂志列为全球最前沿的125个科学问题之一;同时相关社交障碍是科技部近期发布的“科创2030——脑科学与类脑研究”重要战略布局方向,也是上海交通大学医学院新一轮地方高水平创新团队重点建设方向之一。
目前自闭症相关分子、影像和神经机制缺乏突破性进展,领域普遍认为基因可解释其病因学的30%,可为其未来精准诊疗提供部分线索。但是目前基于东亚人群的大规模自闭症遗传数据缺乏,无法针对中国人群特有的遗传背景,探索新的精准靶向干预路径。
在上海交通大学医学院高水平创新团队建设过程中,附属新华医院李斐教授、基础医学院程金科教授与脑智卓越中心仇子龙研究员长期保持密切合作, 依托新华医院童年自闭症多模态数据库,开展大规模家系全外显子测序工作(超过700个自闭症核心家系的二代测序项目),成功筛选出多个东亚人群自闭症致病关键基因。
本研究中团队基于数据库的遗传和表型信息,发现一个发育商较高、不具有智力发育迟滞的自闭症患儿。该患儿仅在Sentrin特异性肽酶1(SENp1)基因上携带一个杂合新发突变(de novo mutation),该突变导致患儿SENp1基因半倍剂量不足。SENp1的基因突变引发自闭症的分子机制尚未被研究报道。
研究团队结合多种动物行为学实验发现,Senp1杂合小鼠具有社交记忆障碍和重复刻板行为的自闭症核心症状,但不具有认知障碍和空间记忆障碍等症状。利用脑片免疫荧光染色和膜片钳电生理记录等技术,研究团队发现Senp1杂合小鼠在压后皮层(retrosplenial agranular cortex, RSA)特异性出现GABA能中间神经元数量增多、锥体神经元抑制性突触增多且兴奋性突触减少等表型(图一)。这提示RSA脑区对于自闭症核心症状具有潜在重要影响。进一步的研究表明,SENp1通过去苏木化酶活性介导脆性X智力低下蛋白(FMRp)去苏木化,从而调控FMRp在突触后的表达量,进而影响兴奋性和抑制性突触形成。研究团队利用病毒立体定位注射技术结合动物行为学实验发现,在RSA脑区回补SENp1蛋白或者FMRp蛋白能有效改善Senp1杂合小鼠自闭症核心症状。该研究首次报道了SENp1作为全新自闭症风险基因在RSA脑区调控自闭症核心症状的分子机制,为深入理解哺乳动物社交行为的遗传基础提供了重要证据,为进一步干预和改善自闭症核心症状提供了全新思路。
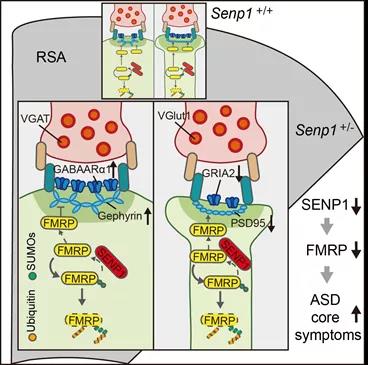
图一:SENp1调控FMRp去苏木化影响自闭症核心症状的分子机制。SENp1半倍剂量不足效应导致FMRp被过度苏木化而过度降解。FMRp在抑制性和兴奋性突触后的表达量下调会导致抑制性突触增加以及兴奋性突触减少。RSA脑区中兴奋性-抑制性突触连接紊乱,将进一步导致RSA脑区无法正确整合感觉信号,从而最终引起自闭症核心症状。

图二:此幅中国画抽象地概括了SENp1在压后皮层调控自闭症核心症状的主要表型。SENp1半倍剂量不足效应(腊梅树干被劈开一半)导致压后皮层(中国式扇形拱门)中未成熟的树突棘(未开放的腊梅花苞)数量增加、成熟的树突棘(开放的腊梅花)数量减少,并伴随大脑皮层变宽变厚(更大的园林假山)。这些表型与社交记忆受损相关(小猫与伙伴无社交互动)。(此画由论文共同第一作者、共同通讯作者杨侃和青年画家邱永智共同创作。
本研究为研究自闭症跨物种多模态病理机制研究方面建立了新范式,联合团队将基于人群队列,结合动物模型基础神经生物学研究,在神经环路、突触连接和特定分子信号转导层次上揭示社交障碍的跨物种保守的关键神经机制;可以预见,团队协作将围绕东亚人群自闭症致病关键基因,发现和鉴定具备转化潜力的干预新靶标,指导自闭症转化医学研究,促进相关的转化医学研究,探索自闭症治疗的新理论和新方法。
该研究主要由中科院脑智卓越中心助理研究员杨侃与博士后石玉含、附属新华医院博士生杜秀娟合作完成。该研究获得了中科院脑智卓越中心徐华泰研究员和昆明医科大学俞珏华教授的重要指导。中科院脑智卓越中心张月芳、单仕芳、袁依婷、范柳,博士研究生王锦程、王若晴、周晨欢、王彦智,上海交大致远学院本科生刘雨婷、蔡子霖共同参与了此项研究。该研究还获得了中科院脑智卓越中心光学平台及胡谦博士、实验动物平台、电镜技术平台、基因编辑平台和分子细胞技术平台的大力支持。该研究由中科院、科技部、国家自然基金委、上海市科委、上海市教委和中国博士后基金共同资助完成。






























