中科院学者发现丝氨酸代谢调控在肠癌转移中的重要作用
11月1日,国际学术期刊Journal of Clinical Investigation在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)杨巍维研究组与复旦大学附属肿瘤医院李大卫教授、李心翔教授,以及广州大学王雄军教授的合作研究成果:“Cul4A-DDB1-mediated monoubiquitination of phosphoglycerate dehydrogenase promotes colorectal cancer metastasis via increased S-adenosylmethionine”。该研究发现了肠癌(CRC)细胞通过诱导单泛素化修饰增强了丝氨酸合成关键酶磷酸甘油酸脱氢酶(pHGDH)的活性,从而促进了丝氨酸合成及一碳单位代谢,增加了胞内S-腺苷甲硫氨酸(SAM)的含量,进而加速了CRC肝转移。
CRC是最常见的消化道恶性肿瘤之一。在过去的几十年里,由于饮食结构和生活习惯的变化,我国城乡居民的CRC发病率呈持续性增高。目前CRC已成为我国发病率前五的恶性肿瘤。约25%的CRC患者在初诊时即被诊断为存在远端转移,约30%的在初诊时无远端转移的CRC患者在后期也会发生远端转移。转移是一个由一系列细胞信号蛋白紧密调控的多步骤级联过程,是导致90%以上的人类癌症死亡的原因。研究调控转移的分子机制对CRC的治疗具有重要意义。
细胞代谢异常与肿瘤的发生发展息息相关,代谢失控已成为癌症的一个重要特点。丝氨酸是一种重要的非必需氨基酸,对肿瘤细胞有多种用途:用于蛋白质合成;作为甘氨酸和半胱氨酸的前体参与鞘磷脂和磷脂的合成;在叶酸介导的一碳通路中裂解生成甘氨酸和一碳单位合成卟啉、胸苷酸、嘌呤、谷胱甘肽和SAM。丝氨酸代谢不仅为肿瘤细胞内蛋白质、核酸和脂质的合成提供必要的前体,还可以为肿瘤细胞中氧化还原稳态的维持提供还原力。因此,丝氨酸代谢对肿瘤的生长至关重要。然而,丝氨酸代谢是否及如何参与肿瘤转移还不清楚。
杨巍维组合作研究发现,丝氨酸合成通路中的关键酶pHGDH的单泛素化修饰促进了CRC转移。泛素连接酶复合体Cul4A-DDB1介导的pHGDH K146位点的单泛素化修饰促进了pHGDH和分子伴侣DNAJA1的相互作用,从而促进了pHGDH四聚体的形成,上调了pHGDH的酶活;pHGDH活性的升高增加了细胞中其下游代谢物SAM的含量;高水平的SAM选择性激活了甲基转移酶SETD1A,促进了细胞黏附基因LAMC2和CYR61启动子的组蛋白H3K4的三甲基化(H3K4me3)修饰,从而促进了LAMC2和CYR61的表达及CRC的肝转移。
通过对大量CRC病人样本分析,他们发现相较于CRC原位端肿瘤组织,肝转移端肿瘤组织中的SAM含量更高;相较于无转移复发的CRC病人,有转移复发的CRC病人血清中SAM的含量更高。
该工作发现了丝氨酸代谢调控促进CRC转移的新功能;揭示了单泛素化修饰调控pHGDH活性及SAM生成促进CRC转移的新机制;提示了阻断丝氨酸合成通路可以抑制CRC肝转移,以及肿瘤组织和血清中SAM的含量可以预测CRC转移及预后。
分子细胞卓越中心杨巍维研究员、复旦大学附属肿瘤医院李大卫教授、李心翔教授和广州大学王雄军教授为该论文的共同通讯作者。杨巍维组张亚娟博士、广州大学喻华博士和上海科技大学张洁博士为该论文的共同第一作者。该项研究工作得到了国家自然科学基金、国家重点研发计划项目、中国科学院青年基础研究项目等资助。该项研究工作得到了分子细胞卓越中心分子生物学技术平台和动物实验技术平台的支持。
文章链接:https://www.jci.org/articles/view/146187
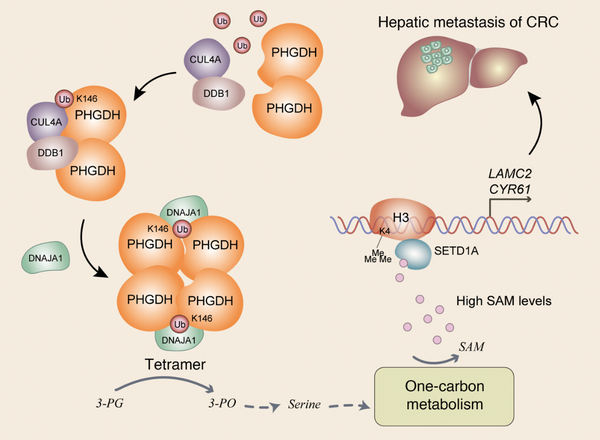
pHGDH的单泛素化修饰促进了肠癌肝转移






























