浙大团队开发出新型聚合物胶束,有望治疗椎间盘退变
椎间盘退变(IVDD)是引起人们腰痛的主要原因,可能产生高昂的医疗费用。外源性人脂肪间充质干细胞(ADSC)移植已被证明对椎间盘退变具有良好的治疗效果。然而,退变区域内活性氧水平(ROS)的升高会抑制人ADSC增殖,并促进细胞凋亡。因此,需要找到一些方法来降低微环境中的ROS水平,以提高人ADSC的活力和功能。
为了解决这些治疗问题,浙江大学的研究人员设计出一种基于夹竹桃麻素(apocynin,ApO)的新型两亲性聚合物胶束,其中胶束核心包载小分子化合物kartogenin(KGN),用于椎间盘退变的治疗。
研究人员发现,这种聚合物胶束能够准确并可控地递送ApO和KGN,这两种分子可以保护人ADSC免受氧化应激,并促进细胞分化成髓核样表型,从而具有治疗椎间盘退变的潜力。这项研究成果于近日发表在《Bioactive Materials》杂志上。
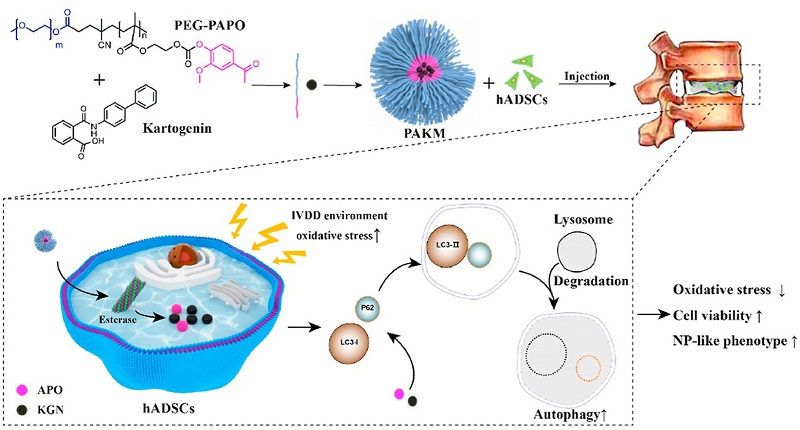
pAKM的设计和合成
为了开发基于聚合物胶束的药物递送系统,研究人员首先通过酯酶响应性的酚酯键将ApO药物连接到聚合物链上,并在胶束的核心包载KGN,形成单一复合物pAKM。ApO作为NADpH氧化酶抑制剂,可刺激人ADSC的增殖,而细胞在KGN的作用下可进一步发育成髓核样表型。
pAKM是一种可注射的聚合物胶束,能够实现ApO和KGN的可控释放。他们随后通过实验证实了pAKM的酯酶响应性。在酯酶存在时,ApO逐步从pAKM中释放。人ADSC在氧化应激下酯酶活性增加,有利于酯酶反应性ApO的释放。(本实验中的人ADSC及培养基由赛业生物提供。)
图1. 合成pAKM的示意图
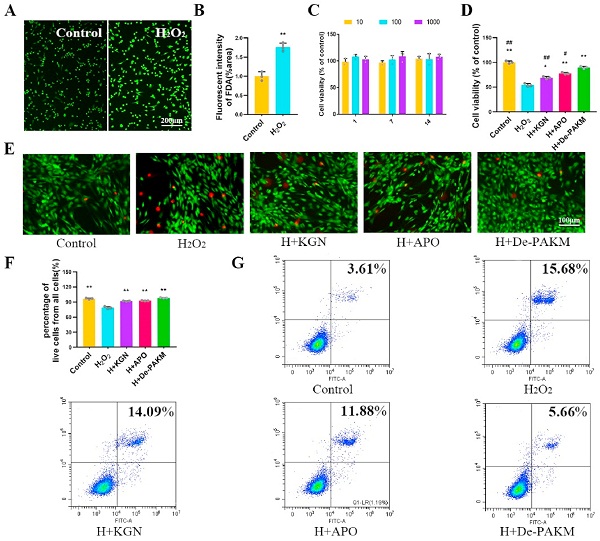
pAKM的生物活性
接下来,研究人员评估了De-pAKM(利用酯酶获得的pAKM降解产物)对细胞活力的影响。人ADSC经H2O2处理后,细胞活力水平为54.1%,而De-pAKM + H2O2组为89.6%,比ApO或KGN单独处理更高,表明De-pAKM是在氧化应激下提高细胞活力的有效工具。同时,De-pAKM处理还能降低H2O2诱导的细胞凋亡,保护人ADSC免受氧化应激(图2)。
图2. pAKM降低炎症刺激后的细胞凋亡并维持细胞活力
当椎间盘发生退变时,纤维环和髓核的含水量逐渐下降,椎间高度降低,髓核细胞(Np)减少,且细胞外基质(ECM)降解。于是,他们又分析了人ADSC中分解代谢基因(MMp-13)以及炎症相关基因(COX-2)的表达。MMp-13是ECM代谢中的主要分解代谢因子。H2O2刺激增加了MMp-13和COX-2表达,但De-pAKM处理最大程度降低了这种增幅,也就是说,De-pAKM显著抑制了H2O2诱导的炎症。
之后,他们还利用DCFH-DA探针评估了H2O2诱导的细胞内ROS产生。免疫荧光分析结果显示,H2O2通常会诱导人ADSC细胞内ROS的增加。不过,与ApO和KGN单独处理相比,De-pAKM处理可更多地诱导抗氧化酶SOD的表达,表明De-pAKM可增强人ADSC抵抗氧化应激的能力。
此外,pAKM还具有很强的抑制ECM降解和诱导人ADSC分化成髓核的能力。与对照、H2O2和H2O2 + ApO组相比,pAKM组表现出最高的SOX9表达水平,这种转录因子的表达与维持健康的ECM之间存在正相关。KRT19通常作为鉴定髓核细胞的阳性标志物。与KGN或ApO处理组相比,用pAKM培养的人ADSC显示出更高的KRT19水平。
自噬在维持干细胞稳态方面起着至关重要的作用,并且可帮助细胞抵抗椎间盘退变中的过度氧化应激。通过自噬标志物LC3 II的免疫荧光分析,研究人员发现De-pAKM能更有效地激活人ADSC中的自噬,从而抑制了H2O2诱导的氧化应激。
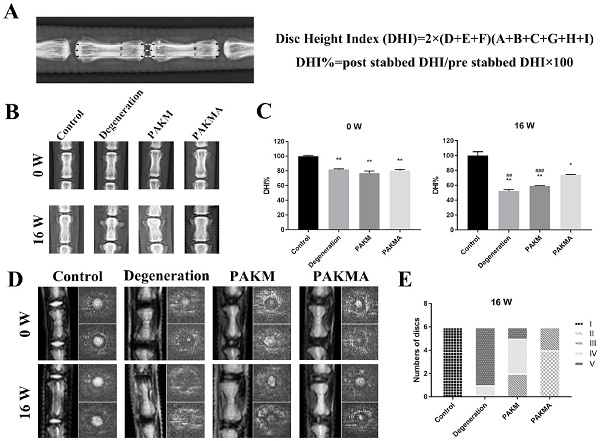
pAKM的体内治疗效果
最后,研究人员还通过X射线分析评估了椎间盘高度,以评估pAKM的体内治疗效果;并通过磁共振成像(MRI)评估了椎间盘含水量。他们发现,将pAKM与人ADSC一起注射到大鼠体内能够提高椎间盘高度和含水量,表现出良好的治疗潜力(图3)。
图3. 通过X射线分析评估椎间盘高度
结语
综上,研究人员开发出一种可注射的酯酶响应性胶束pAKM,将ApO和KGN共同递送到椎间盘中。分析结果证明了pAKM的生物安全性,以及它能够刺激人ADSC的分化,并通过抑制氧化应激来保护细胞。他们认为,pAKM与人ADSC的结合使用可以在体内减轻椎间盘退变,为生物疗法的开发提供了一种新策略。
原文检索
Yu C, Li D, Wang C, et al. Injectable kartogenin and apocynin loaded micelle enhances the alleviation of intervertebral disc degeneration by adipose-derived stem cell. Bioact Mater. 2021 6(10):3568-3579. doi: 10.1016/j.bioactmat.2021.03.018.