我国学者在间充质干细胞成骨分化研究领域取得进展
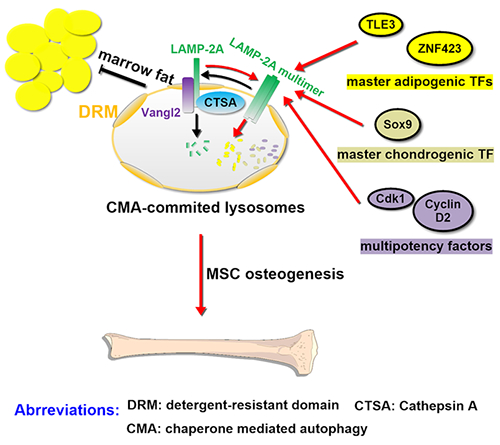
图1 溶酶体调节间充质干细胞分化的机制模式图
在国家自然科学基金项目(批准号:81991511、81625015)等资助下,南方医科大学白晓春、邹志鹏研究团队发现溶酶体在间充质干细胞多向分化中起重要调控作用,研究成果以“Vangl2通过调控分子伴侣介导的自噬平衡间充质干细胞的成骨分化(Vangl2 limits chaperone mediated autophagy to balance osteogenic differentiation in mesenchymal stem cells)”为题,于2021年7月1日在线发表于《发育细胞》(Developmental Cell)。论文链接:https://www.cell.com/developmental-cell/fulltext/S1534-5807(21)00518-9。
溶酶体在传统意义上是细胞内回收和处理废弃物质的“垃圾处理站”,但近期研究显示其还具有调控细胞膜修复、细胞代谢和免疫反应等多种作用。该研究发现,溶酶体的一种亚类——分子伴侣介导的自噬(chaperone mediated autophagy, CMA)溶酶体,通过降解多种阻碍间充质干细胞成骨分化的关键因子,例如TLE3,ZNF423和SOX9等,可从转录后蛋白组学层面调控间充质干细胞的分化进程,从而平衡间充质干细胞的成骨分化。
Vangl2是平面细胞极性信号通路的关键组分,在极性上皮细胞中定位于质膜。该研究发现,在间充质干细胞中,Vangl2高度富集于CMA溶酶体膜的脂筏中,并同时将组织蛋白酶A(CTSA)与溶酶体相关膜蛋白2A(LAMp-2A)铆定于该脂质区域,这一蛋白复合物促进了LAMp-2A的降解,从而自我限制CMA溶酶体的活性。Vangl2缺失则导致CMA溶酶体的激活,选择性降解上述成骨抑制因子,从而促进间充质干细胞的成骨分化(图1)。
该研究系统阐述了溶酶体在间充质干细胞多向分化中的关键作用,揭示了Vangl2通过LAMp-2A信号通路自限CMA溶酶体活性的重要功能,还提示通过基因编辑等方法精确控制Vangl2的表达及CMA溶酶体活性,可能为利用间充质干细胞防治骨质疏松、骨缺损及骨代谢失衡等相关疾病提供潜在治疗靶点。






























