蒋争凡实验室发现“STING相分离器”调节天然免疫
细胞内有许多无膜包被的生物分子凝集体,能为一系列生化反应提供特定的空间,如蛋白-RNA组成的核仁、DNA损伤修复区域、应激颗粒等。目前的研究表明大多数的凝集体由生物分子通过相分离形成。生物凝集体拥有独特的物化性质,在生化反应速率、特异性、膜泡融合及不同细胞器间物质运输和贮藏等方面发挥重要功能。目前蛋白质相分离的研究大多集中在可溶性蛋白,或者与膜蛋白结合的可溶性蛋白,跨膜蛋白相分离形成细胞内膜结构鲜有报道。
立方膜结构是哥伦比亚大学pappas和Brandt于1959年在变形虫细胞中最先发现的、由线粒体膜形成的三维周期性立方相膜结构。此后60多年有数百篇研究论文报道类似的立方膜结构几乎存在于所有生命体的各种细胞中,并且可从任何一种细胞膜变化而来。如蓝藻光合类囊体膜形成“螺旋状晶格”膜结构、植物韧皮部中结构相同但晶格不同的两种立方膜结构。动物细胞中,立方膜经常出现在病理(感染、肿瘤及自身免疫病)条件下,如病原微生物感染诱导不同的细胞器膜形成立方膜,其中内质网来源的立方膜结构长期被作为乙肝病毒HBV或艾滋病毒HIV感染的病理学标志(两类病毒都激活cGAS-STING通路),比如绝大多数艾滋病患者的淋巴细胞具有独特的内质网立方膜。然而,至今为止,人们对这些奇异膜结构产生的原因和功能几乎一无所知。与此相关的奇特现象是:由于该类结构被不同研究者在不同细胞的不同细胞器膜发现,它们的起因和功能又都未知,因此这类膜结构有超过130种不同的命名。
cGAS是胞质内双链DNA或Mn2+受体,它是一个二核苷酸环化酶。被DNA和/或Mn2+激活的cGAS合成第二信使2’3’-cGAMp,后者进一步激活STING(MITA/ERIS),最终激活机体的抗病毒/抗肿瘤天然免疫反应;而Mn2+单独激活的cGAS以一种更高效的路径合成2’3’-cGAMp。STING是分布于内质网的4次跨膜蛋白,与2’3’-cGAMp结合后需要发生转运,离开内质网经高尔基体,最后到高尔基体来源的小膜泡上(称之为STING translocators);而为什么STING必需去高尔基体活化这个问题一直很不清楚。最近北京大学蒋争凡实验室通过基于STING过度活化导致细胞死亡而进行的全基因组CRISpR/Cas9筛选,发现STING的活化需要两种配体:1)细胞质里的环化二核苷酸(如2’3’-cGAMp),2)高尔基体内的硫酸化糖胺聚糖(sGAGs)。前者诱导STING转移到高尔基体,后者导致STING多聚化,招募并激活TBK1。sGAGs与STING结合后,像铰链一样引发STING发生多聚化,进而招募并促进TBK1的自磷酸化及下游通路活化(Fang et al., 2021,Immunity)。重要的是,cGAS也会被泄露到细胞质的自身DNA或细胞内累积的Mn2+激活,在抗肿瘤免疫,自身免疫病,细胞损伤及衰老等过程中发挥重要作用。Mn2+和pD-1抗体联合使用的“锰免疗法”可显著增强pD-1抗体的肿瘤治疗效果。类似Mn2+通过激活cGAS-STING通路促进肿瘤治疗的方法也被国内外多个实验室所发现或证实。
目前,蛋白质相分离参与天然免疫调节的研究刚刚开始,仅有的两个报道是发现了cGAS与DNA结合后发生二聚化/寡聚化并导致cGAS蛋白的相分离,其中锌离子(Zn2+)是一个重要的促进因子。2021年4月8日,生命中心蒋争凡实验室在《Nature Cell Biology》上以Research Article形式在线发表了他们在天然免疫及蛋白质相分离领域的最新研究成果—The STING phase-Separator Suppresses Innate Immune Signaling。
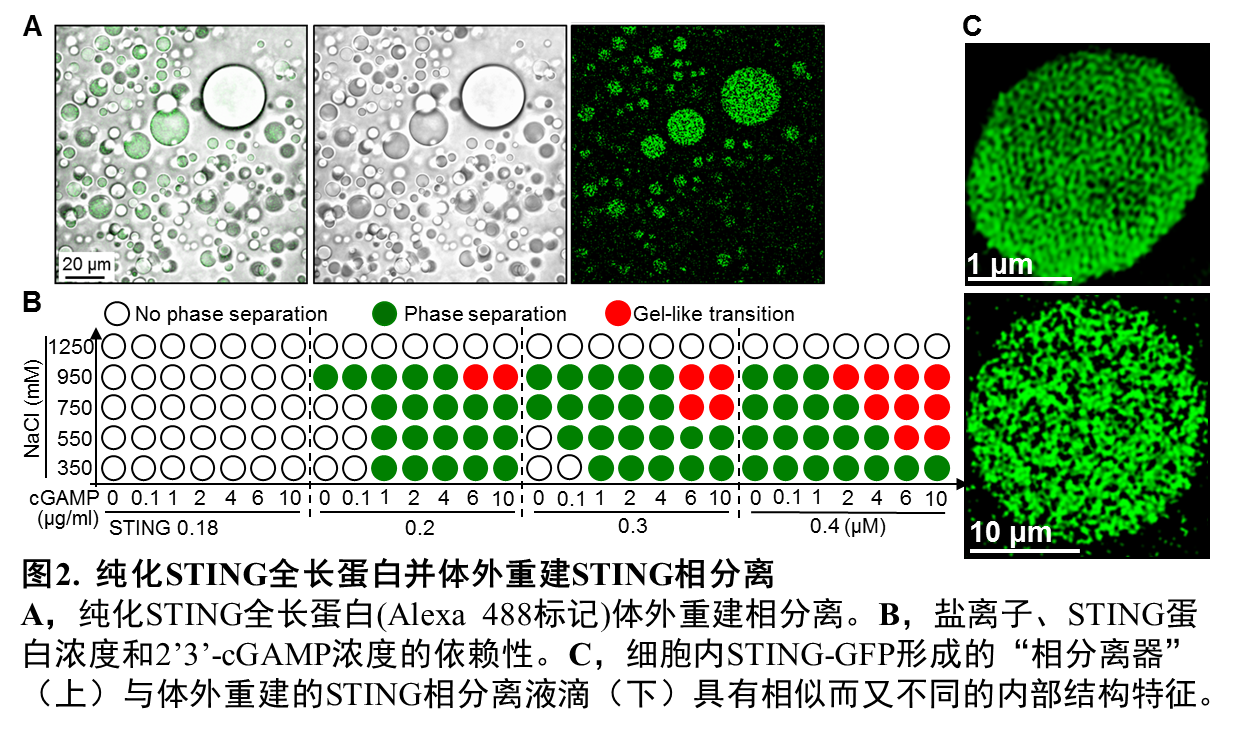
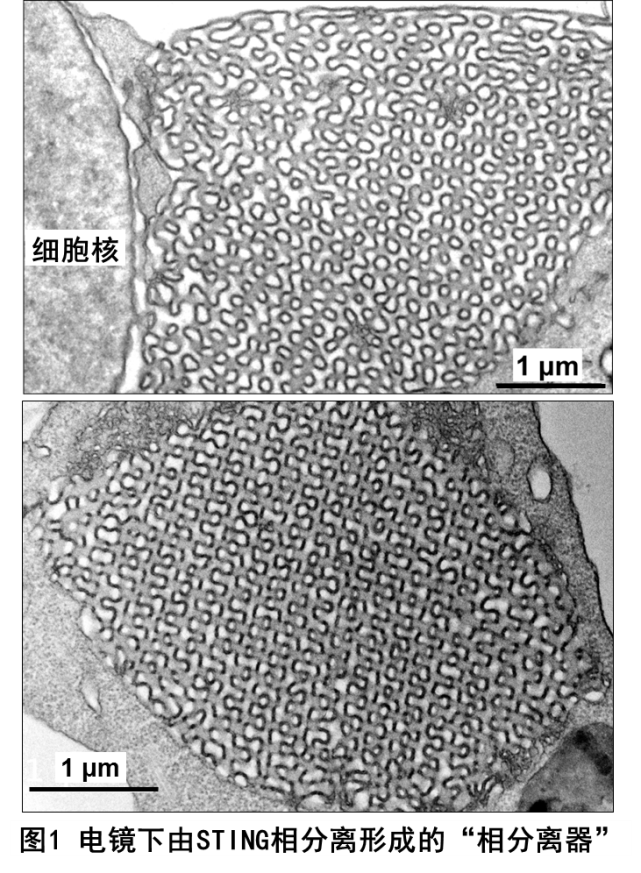
本研究工作中,蒋争凡实验室的于晓彧同学首先发现在DNA病毒感染后期的细胞内,或体外用STING激活剂(2’3’-cGAMp、c-di-GMp)处理的细胞内,均可观察到未进行高尔基体转运的STING蛋白在内质网膜形成不少有高度液滴性质的微米级别的凝集体。荧光漂白技术发现细胞内STING形成的凝集体非常类似于可溶性蛋白发生液相-液相分离形成的相分离液滴。更令人惊奇的是,光镜-电镜联合技术并结合免疫电镜显示STING蛋白形成的凝集体是一个由内质网膜形成的、高度特化的内部像拼图样(puzzle-like)的膜结构;三维重组后的结果则显示在细胞核周围形成“蜂窝状”的“类细胞器”样结构,非常类似于艾滋病患者淋巴细胞中广泛存在的内质网“立方膜结构”(图1)。STING-ApEX标记、染色的电镜下呈现的STING相分离膜结构中充满了密布STING的、由内质网囊泡堆叠、挤压形成的“单位膜”;而电镜下STING translocators则显著不同,ApEX染色显示为直径100 nm左右的小膜泡,STING非常密集地分布于膜泡外周。他们利用纯化的STING全长蛋白在体外重建了相分离体系,并进行了一系列的机制研究:发现超过一定阈值的2’3’-cGAMp可强烈诱导STING蛋白发生相分离;而Mn2+可显著降低所需的2’3’-cGAMp浓度,Mg2+或Zn2+则无此作用。有趣的是,体外重建获得的STING相分离液滴具有类似细胞内立方膜但又不同的内部结构特征(图2)。细胞质中,病毒感染后活化的cGAS持续性地产生并且累积2’3’-cGAMp,而目前尚没有发现细胞质内特异性降解2’3’-cGAMp的磷酸酯酶。这些结果提示:细胞内适度水平的2’3’-cGAMp会诱导STING转运至高尔基体并发生抗病毒天然免疫通路的活化;而在病毒感染后期,细胞内过度累积的2’3’-cGAMp则能够诱导留存在内质网、没有被活化的STING蛋白发生相分离。后续的实验结果提示STING相分离产生的内质网膜“立方膜结构”可能通过在空间上将STING-TBK1与关键转录因子IRF3进行“隔离”,进而负调节cGAS-STING通路。因此,这个由细胞内高浓度2’3’-cGAMp触发、Mn2+促进、STING蛋白相分离形成的内质网立方膜结构被命名为“STING相分离器”(The STING phase -Separator),用于隔离细胞内未激活的STING-TBK1(也包括与STING结合的2’3’-cGAMp),从而在另外一个层次保证天然免疫不会过度活化(图3)。实际上,该内质网立方膜结构的作用方式可能像一个细胞内的2’3’-cGAMp-STING-TBK1“海绵”,吸附并隔离天然免疫关键分子。这样的负调节机制还暗示细胞可能并不需要胞内的特异性磷酸二酯酶来水解病毒感染后期细胞质中过度累积的2’3’-cGAMp。

这些结果也提示60余年前发现的存在于几乎所有生命体各种细胞内的各类立方膜结构的形成可能受相关跨膜蛋白相分离的驱动;而由膜蛋白相分离形成的这类膜结构是细胞正常生命活动的一部分,并在多种生理、病理过程中扮演重要角色。因此,通过蛋白相分离的角度研究这些细胞内独特膜结构的形成与生理学功能,尤其是病理学功能可能具有重要的理论及实际意义。
北京大学生科院2016级博士生于晓彧同学为论文的第一作者,北大-清华生命科学联合中心/生科院的蒋争凡教授为通讯作者。生科院2019级博士生张沥元同学帮助了本项研究。本研究工作得到了“北大-清华生命科学联合中心”、国家自然科学基金委、科技部国家重点基础研究项目及北京大学“细胞增殖与分化”教育部重点实验室的资助。
原文链接:https://dx.doi.org/10.1038/s41556-021-00659-0






























