上海药物所利用肿瘤激活的仿生脂蛋白载药系统提高瘤内药物递送并增强抗肿瘤免疫应答
近年来,免疫检查点抑制剂(ICB)在肿瘤临床治疗中取得重要进展,但肿瘤组织的低免疫原性以及强烈的免疫抑制微环境严重制约了其临床疗效。将诱导肿瘤细胞免疫原性死亡(ICD)的药物递送至肿瘤细胞,有望克服这一关键难题。但是,肿瘤组织细胞外基质(ECM)相互交联形成了致密的瘤内递送屏障,严重阻滞了药物在瘤内的渗透和递送。如何突破瘤内递送屏障、将ICD诱导剂高效递送到肿瘤细胞,成为增强抗肿瘤免疫应答、提高ICB治疗效果的先决条件。
8月16日,《先进材料》(Advanced Materials)杂志以“Tumor-Activated Size-Enlargeable Bioinspired Lipoproteins Access Cancer Cells in Tumor to Elicit Anti-Tumor Immune Responses”为题在线发表了上海药物所张志文研究员、张翱研究员和李亚平研究员团队合作的最新研究成果。该工作提出并证实利用肿瘤激活的仿生脂蛋白载体系统突破瘤内递送屏障的递送策略,将ICD诱导剂高效递送至瘤内肿瘤细胞,激活抗肿瘤免疫应答,显著增强了anti-pD-1等ICB的治疗效果。
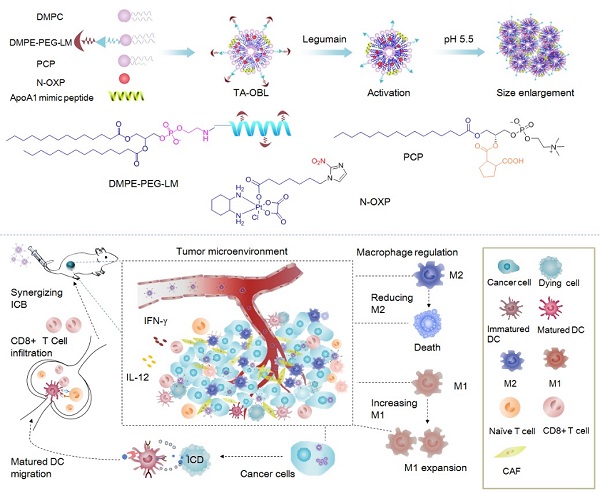
该研究设计合成了ICD诱导剂奥沙利铂的功能性前药(N-OXp)、胞内微酸响应磷脂衍生物(pCp)以及Legumain酶响应的蜂毒前肽衍生物(DMpE-pEG-LM),并将其构建为肿瘤激活的仿生脂蛋白载药系统(TA-OBL)。研究发现TA-OBL能够高效蓄积在肿瘤部位并渗透进入肿瘤深部区域,到达肿瘤细胞并诱导ICD,增强肿瘤免疫原性,使瘤内杀伤性T细胞比例提高4倍,免疫抑制性M2巨噬细胞降低了77%,并显著提高了瘤内免疫杀伤因子(IFN-γ、IL-12)的水平。在乳腺癌4T1、结肠癌CT-26等肿瘤模型中,TA-OBL与anti-pD-1、anti-CD47等ICB协同增效,显著抑制了肿瘤的生长并延长了荷瘤小鼠的生存期。因此,该研究为利用纳米载体系统提高瘤内药物递送提供了一种有效递送策略,并为增强抗肿瘤免疫应答提高ICB治疗效果提供了一种有意义的探索。
上海药物研究所张志文研究员、张翱研究员和李亚平研究员为本文的共同通讯作者,上海科技大学和中科院上海药物所联合培养博士生李杰为第一作者。该研究得到了中国科学院战略性先导科技专项(A类)、国家自然科学基金、山东省自然基金等项目的资助。
全文链接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202002380