一把“双刃剑”插入两大细菌防御系统
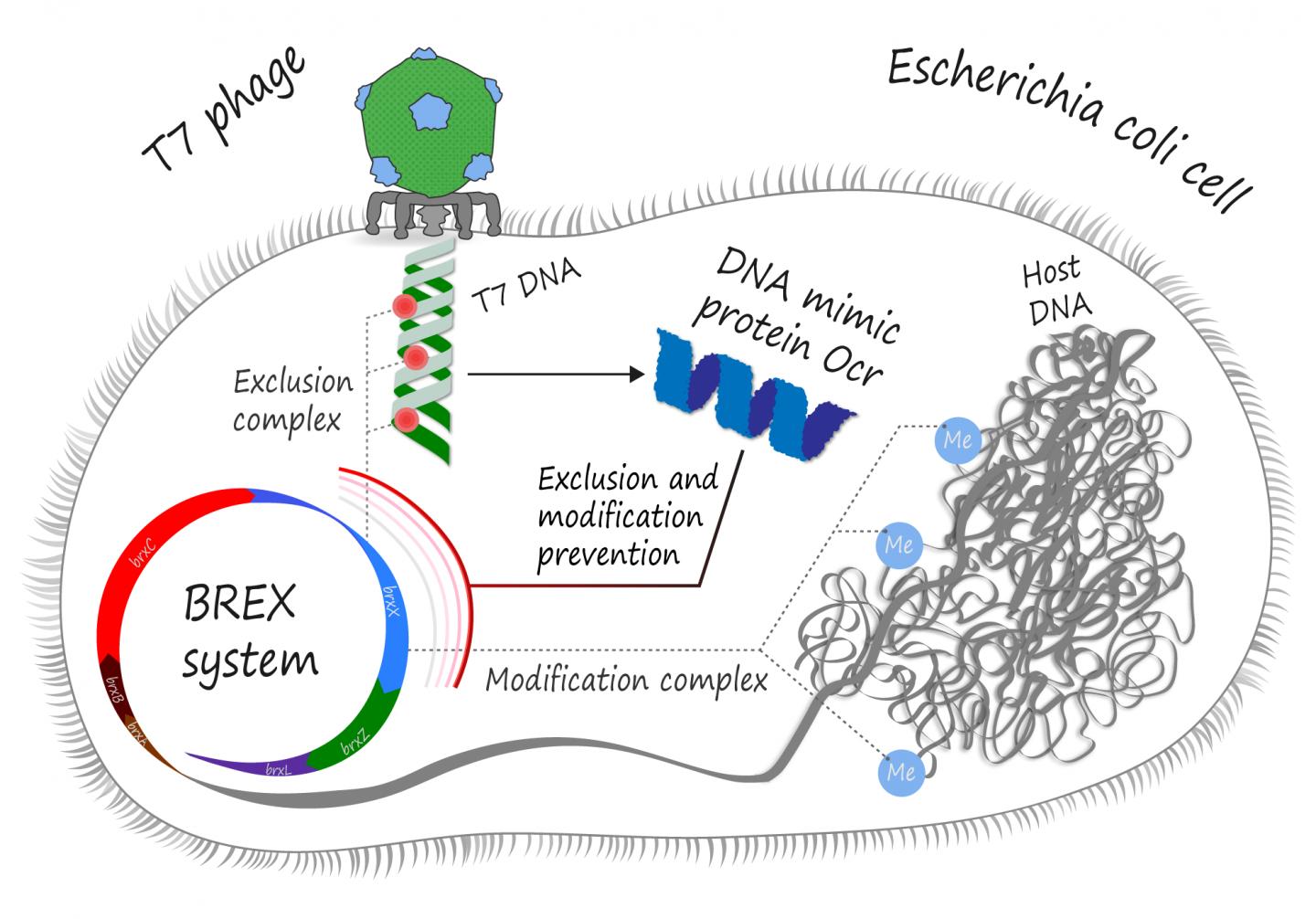
细菌VS噬菌体,它们之间存在着永无止境的战争,为了保护自己免受恶意入侵,细菌学会了在基因组特定位置甲基化来标记自己的遗传物质,而未被标记的DNA(如噬菌体DNA)就会被一大群核酸内切酶识别、切割,最终降解,即细菌的限制修改(restriction modification,RM)系统。
反过来,噬菌体也学会了利用DNA模拟蛋白来逃避RM系统,一种在化学上“看起来”像DNA的蛋白质可以与细菌限制性复合物结合,阻止其与真正的噬菌体DNA结合。
Skoltech科技研究所的博士生Artem Isaev和来自特拉维夫大学(Tel Aviv University)和菲利普莫里斯国际研发中心(philip Morris International R&D)的同事在《Nucleic Acids Research》上发表文章,证明T7噬菌体DNA模拟蛋白质Ocr实际上具有多面性,除了能抑制RM I 系统,还可以保护噬菌体免受另一套名为BREX(BacteRiophage EXclusion)的细菌防御机制影响。
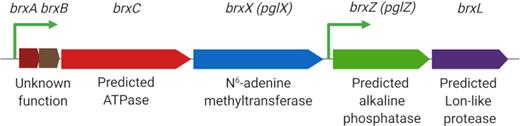
“5年前,我们就知道RM、CRISpR和毒素-抗毒素(Toxin-Antitoxin,TA)系统,但直到最近生物信息学告诉我们,这些只是细菌应对噬菌体感染所采取的多样性防御策略的一小部分。而BREX则属于一系列新被发现的防御系统,在微生物界它的占比约为十分之一,每十种微生物中就有一种含有BREX,在细菌中甚至比CRISpR更广泛。然而,BREX的基因功能还有六分之五有待解锁,”Isaev说。
BREX对噬菌体DNA是简单地进行摧毁还是以某种方式抑制其复制,这些还不得而知,但几乎所有BREX机制都使用BrxX甲基转移酶,这种酶是标记细菌DNA以自我识别的酶,噬菌体的Ocr蛋白能与这种甲基转移酶结合,从而阻止BREX系统对宿主DNA的甲基化和对非甲基化噬菌体基因组的攻击。
“我们证明了Ocr与甲基转移酶相互作用,并抑制了宿主DNA甲基化。理论上这会导致自身免疫反应:宿主DNA不再被标记为自身,那么BREX复合物就会攻击这些宿主DNA。然而,实际情况是Ocr表达后并没有出现自身毒性,说明Ocr也抑制了这些清缴复合物。BREX和RM系统之间还有其他相似之处,我们希望它们能帮助我们理解BREX的功能,”Isaev解释。
其他DNA模拟蛋白似乎无法克服BREX防御,细菌防御系统主要处理DNA识别和操作,它们可以成为分子生物学和医学的有力工具——因为有了RM系统的发现和描述,分子克隆成为可能;CRISpR让人们跨入基因组编辑的革命时代。进一步研究Ocr究竟如何发挥作用将有可能招募这些新型抗菌剂来对抗耐药细菌。
原文检索:phage T7 DNA mimic protein Ocr is a potent inhibitor of BREX defence
(生物通:伍松)