深圳大学Nature子刊报道膀胱癌分子驱动机制与血管生成调控新发现
膀胱癌发病率位列男性全身恶性肿瘤发病率第7位,为泌尿生殖系统常见恶性肿瘤,其发病率随着年龄的增长而增加,且发病趋于年轻化。膀胱癌的生物学行为突出表现为易复发与多发,转移是其致死的主要原因。膀胱癌作为高度血管化的肿瘤,其复发转移与肿瘤血管新生有着密切的联系,但血管生成与调控的遗传基础仍不明确。
来自深圳大学的研究人员发表了题为“Whole-genome sequencing identifies ADGRG6 enhancer mutations and FRS2 duplications as angiogenesis-related drivers in bladder cancer”的文章,在膀胱癌分子驱动机制与血管生成调控方面取得进展。
这一研究发现公布在Nature Communications杂志上,由吴松教授领导完成,深圳大学泌尿外科研究所为第一作者单位。
在这篇文章中,研究人员通过组学结合临床随访分析,解析了膀胱癌突变特征谱,鉴定到一系列因基因编码区与非编码调控区突变以及基因组结构变异而改变的高频突变基因,其中包括膀胱癌重要功能基因Tp53与新的驱动因子ADGRG6与FRS2。
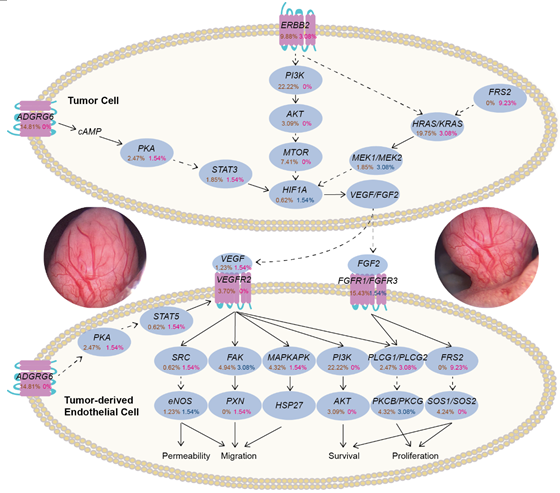
病理与生存分析表明ADGRG6增强子突变与FRS2拷贝数扩增导致其编码蛋白高在肿瘤组织中表达,且关联高密度微血管与不良预后。ADGRG6是一种新型粘附G蛋白偶联受体,高表达于内皮细胞中,在血管生成中发挥重要作用。FRS2(成纤维细胞生长因子受体底物2)是一种衔接蛋白,能与细胞生长调控相关的多种受体结合,介导下游信号通路的激活过程,从而发挥重要生物学功能。
此外,通路分析揭示大量高频突变基因在膀胱癌血管生成与调控相关通路中富集(图)。该研究解析了膀胱癌的多维度突变特征谱,突出了非编码区突变与基因组结构变异在膀胱癌中的重要作用,揭示了膀胱癌高丰度血管生成与调控的遗传基础,提示ADGRG6和FRS2可作为膀胱癌抗血管生成治疗的新靶点。
高频突变基因在膀胱癌血管生成与调控相关通路中富集
原文标题:
Whole-genome sequencing identifies ADGRG6 enhancer mutations and FRS2 duplications as angiogenesis-related drivers in bladder cancer