Nature Chemical Biology:糖基化调控MDH1酶活性促进胰腺癌生长的分子机理
2022年7月25日,生命科学学院周如鸿教授团队和易文教授团队合作在生物化学及分子生物学高影响力期刊Nature Chemical Biology上发表了题为“O-GlcNAcylation promotes pancreatic tumor growth by regulating malate dehydrogenase 1”的研究论文,揭示了O-GlcNAc糖基化调控pDAC细胞生长的新机制,并解释了糖基化增强MDH1活性的分子机理。这一发现对胰腺癌药物的研发具有潜在的指导意义。

胰腺癌是一种恶性程度极高的消化系统肿瘤,确诊后患者的五年生存率仅为10%左右。代谢改变是肿瘤细胞的重要标志之一。肿瘤细胞通过代谢重编程产生快速增殖所需的物质、能量以及氧化还原力。癌基因Kras激活的胰腺导管腺癌(pDAC,胰腺癌中最常见的病理类型)细胞高度依赖一种特殊的谷氨酰胺(Gln)分解代谢途径。在该途径中,Gln首先被转化成天冬氨酸(Asp),随后在谷草转氨酶(GOT1)催化下形成草酰乙酸(OAA),OAA经苹果酸脱氢酶(MDH1)催化进一步被转化为苹果酸(Malate),Malate被苹果酸酶(ME1)氧化最终形成丙酮酸(pyruvate)和还原型辅酶Ⅱ(NADpH),后者能提供还原当量,维持细胞内氧化还原平衡。该途径对于pDAC细胞增殖至关重要,因此深入了解这一途径的调控机制有助于为pDAC的临床治疗提供新的思路和靶点。
O-GlcNAc糖基化修饰是通过N-乙酰葡糖胺以β-糖苷键形式共价连接到蛋白质的丝氨酸(Ser)或苏氨酸(Thr)羟基上的一种翻译后修饰。该修饰是一种高度动态的修饰方式,会随着细胞内的营养状态和细胞外的刺激发生快速的变化。该修饰广泛发生在细胞内的蛋白上,并调控基因转录、信号传导、蛋白合成和代谢重编程等重要的生物学过程。之前的研究表明Kras激活突变促进了细胞的O-GlcNAc 糖基化修饰,并且O-GlcNAc 糖基化修饰水平的异常与pDAC的发生发展有着密切的关系。然而O-GlcNAc 糖基化调控pDAC增殖和成瘤的分子机制有待进一步研究。易文教授课题组研究发现糖基转移酶OGT的表达在胰腺癌病人组织中显著升高,敲低OGT显著抑制了pDAC细胞的Gln代谢,从而抑制了pDAC细胞增殖。进一步研究发现O-GlcNAc修饰通过调控Gln代谢途径中的关键酶MDH1来促进pDAC细胞增殖。他们通过高分辨质谱结合点突变的方法鉴定出Ser189位为MDH1的糖基化修饰位点。体外酶活实验表明MDH1 Ser189位上的糖基化可以增强其酶活性。靶向代谢组学实验证实了MDH1糖基化促进Gln代谢和NADpH的产生。此外,MDH1参与细胞内协调糖酵解和线粒体呼吸作用的苹果酸-天冬氨酸穿梭途径,MDH1糖基化会导致有效的NADH再生,从而促进了线粒体呼吸。小鼠体内成瘤实验和临床样本分析也进一步验证了MDH1 Ser189位的糖基化修饰对pDAC生长的促进作用。
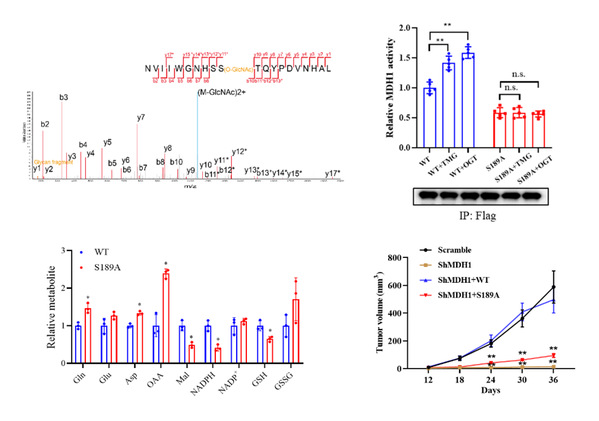
图1:MDH1 Ser189位的糖基化修饰促进了其酶活以及pDAC生长
为了进一步了解O-GlcNAc糖基化增强MDH1蛋白酶活性的分子机制,周如鸿教授团队利用全原子分子动力学模拟对MDH1单体-底物(NADH,MAK)复合物在Ser189糖基化和非糖基化形式下的动力学行为进行了探究。结果表明底物在糖基化情况下更加稳定,结合概率更高。这得益于Ser189 O-GlcNAc对底物结合口袋的保护,促使MDH1与底物,底物与底物之间相互作用增强。通过进一步检查结构细节,他们发现MDH1和底物之间增强的相互作用主要来自Ser189 O-GlcNAc与蛋白残基Gln228、Gln229和Arg98的接触贡献。相应的三联体突变(Q228A/Q229A/R98A)活性分析实验也证实了这一观察结果。此外,与单体不同,MDH1二聚体在非糖基化和糖基化形式下的底物结合并没有表现出显著差异。这可能是由于参与底物结合口袋的螺旋区域受到了二聚体界面相互作用的约束,不似单体中那样灵活,Ser189 O-GlcNAc难以对其产生显著影响。总的来说,他们发现Ser189 O-GlcNAc可以充当“分子胶”的作用,通过稳定MDH1单体上的底物结合口袋,增强蛋白与底物,底物与底物之间的相互作用,来提高底物的结合及稳定性,最终促进MDH1的酶活性。
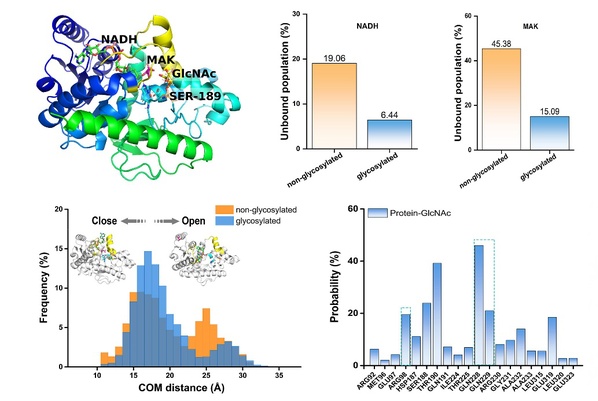
图2:MDH1 Ser189位上的O-GlcNAc糖基化促进其酶活性的分子机理揭示
综上所述,该研究揭示了OGT-MDH1轴在pDAC发生和发展过程中的主要功能。鉴于MDH1在pDAC中高表达,且MDH1糖基化水平与pDAC进程呈正相关,该研究成果的发现强调了干预MDH1糖基化可以作为治疗pDAC的潜在策略。

图3:MDH1糖基化调控pDAC生长的工作模式图
浙江大学生命科学学院博士后朱强和博士后周红为论文的第一作者(并列),周如鸿教授和易文教授为论文的通讯作者,王勇研究员也参与了这项工作。这项工作是糖化学生物学、肿瘤生物学和计算生物学多学科领域交叉融合的研究成果,得到了国家重点研发计划、国家自然科学基金、国家自主创新示范区上海张江重大专项、浙江大学癌症研究院团队培育项目、浙江大学上海高等研究院繁星科学基金等资助。
原文链接:https://www.nature.com/articles/s41589-022-01085-5