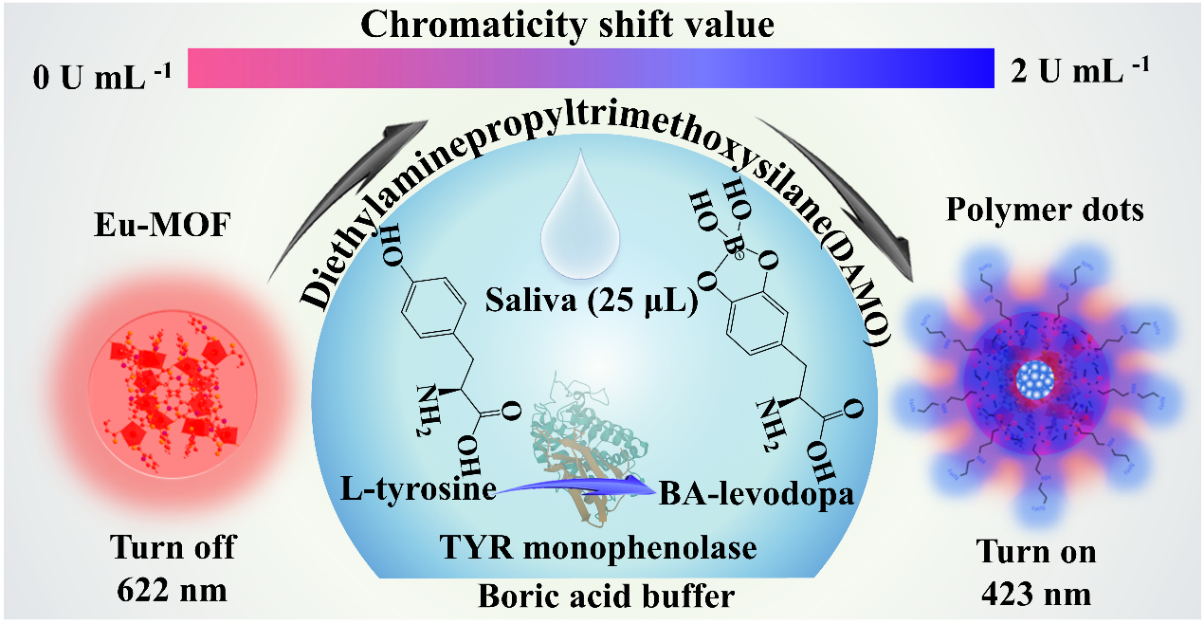
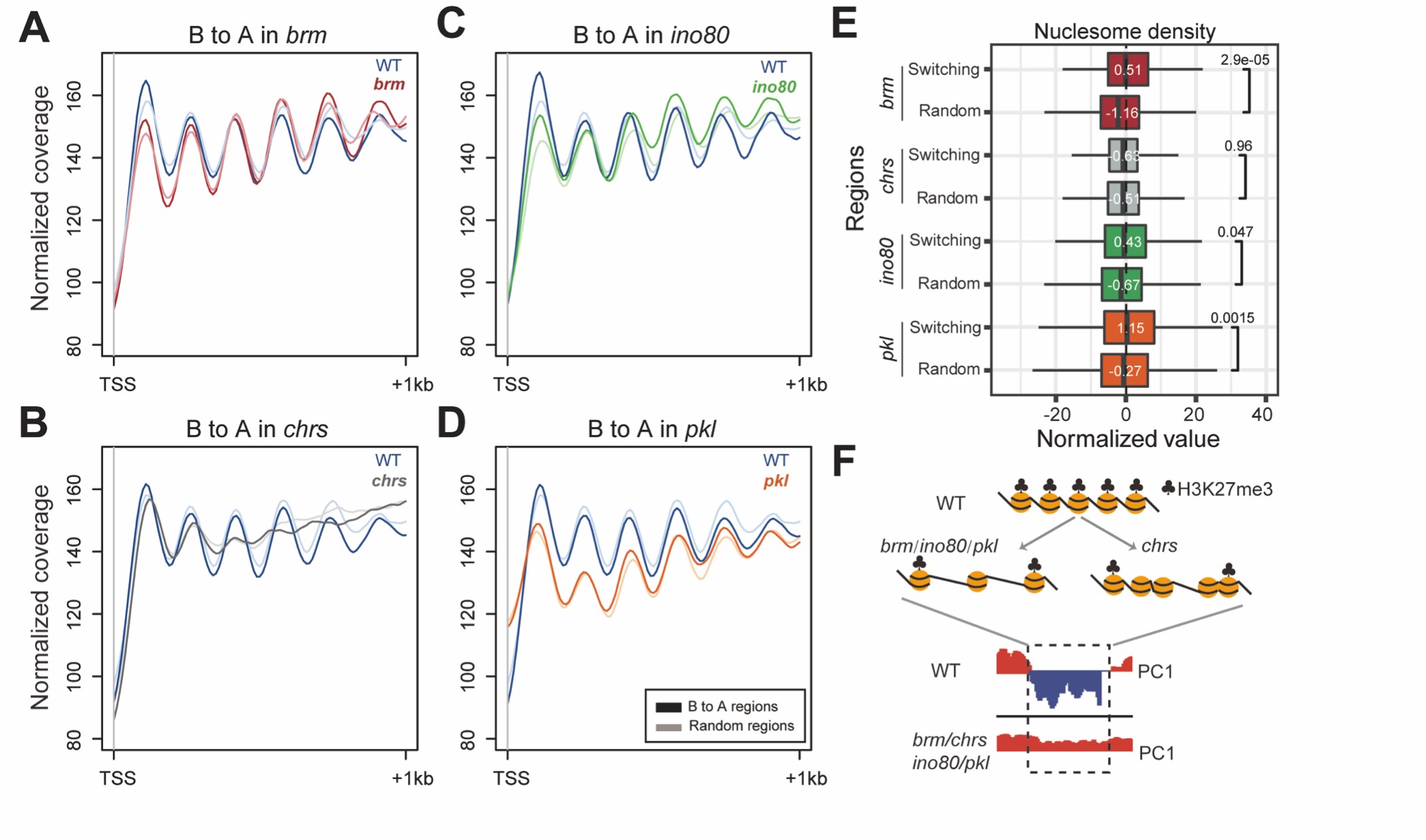
李继喜课题组发现胶质母细胞瘤的高效预后标志物
2022年4月28日,我院李继喜教授课题组在《Journal of Inflammation Research》杂志上发表题为“Systematic Analysis of Chemokines Reveals CCL18 is a prognostic Biomarker in Glioblastoma”研究论文,系统分析和鉴定了趋化因子在胶质母细胞瘤预后中的作用。
胶质母细胞瘤(Glioblastoma, GBM)是成人中枢神经系统中最常见的恶性肿瘤,发病率和致死率高,缺乏有效的早期诊断和治疗手段,被认为是神经外科中最棘手的难治性肿瘤之一。2016年世界卫生组织(WHO)将胶质瘤分为Ⅰ至 IV级。其中GBM作为IV级胶质瘤,恶性程度最高,进展快、易复发;患者中位总生存期(Overall survival, OS)时间约为8个月,五年生存率仅为约6.8%。复杂的肿瘤微环境(TME)是导致GBM治疗困难的关键因素之一。通过趋化因子和趋化因子受体之间的相互作用,不同的免疫细胞亚群被招募到TME中,从而实现肿瘤细胞与宿主免疫系统之间的精细调控。越来越多的研究表明,趋化因子可直接影响癌细胞增殖从而调控肿瘤进展,或通过间接调节免疫细胞的募集,影响肿瘤生长和转移。然而,不同趋化因子对GBM预后影响的系统性分析仍然缺乏。
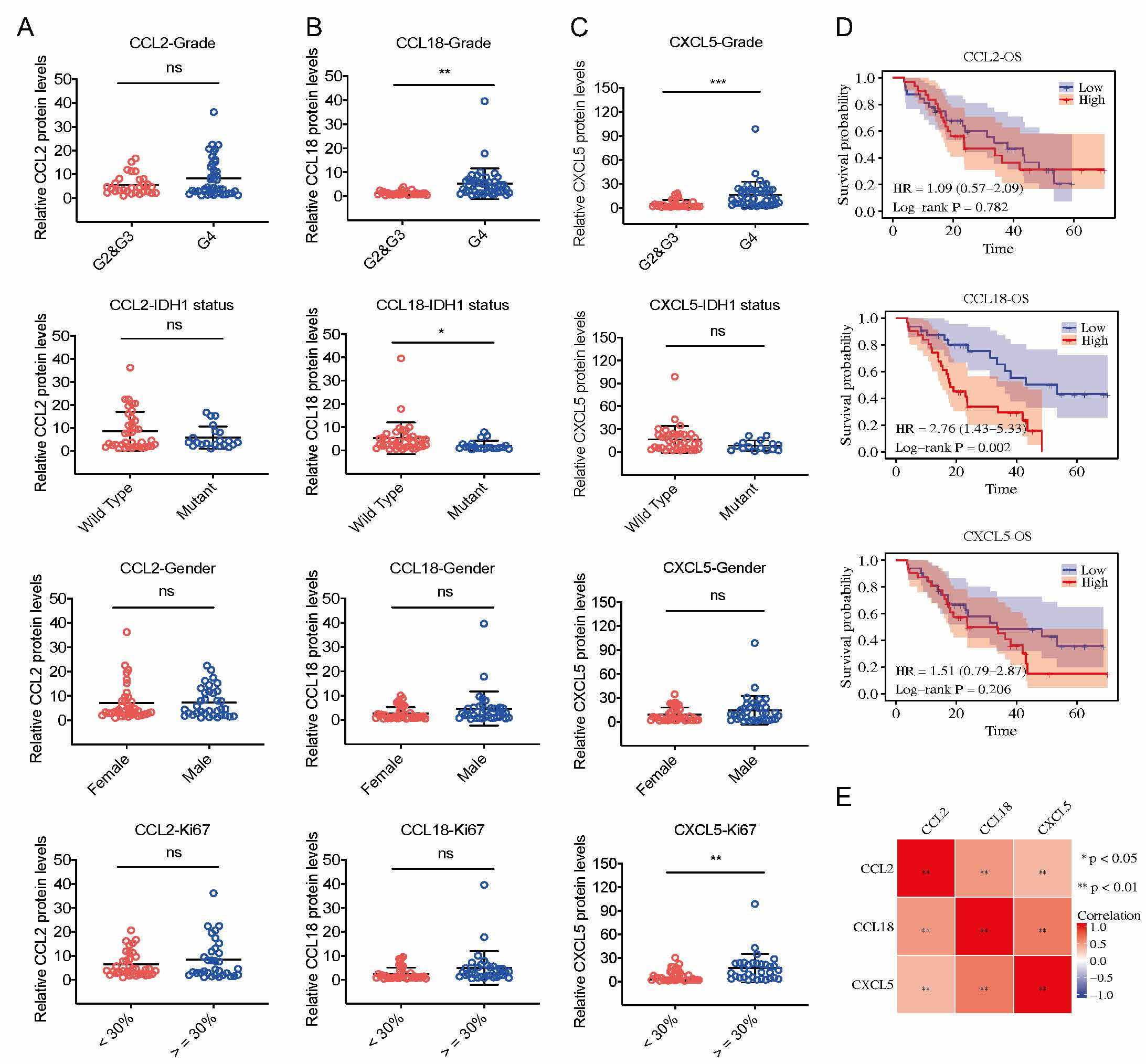
图1,胶质母细胞瘤样本不同趋化因子的蛋白表达水平和预后分析
复旦大学生命科学学院李继喜课题组长期从事细胞死亡与免疫应答研究。在本研究中,李继喜团队联合温州医科大学苏志鹏团队通过癌症基因组图谱(TCGA) 数据库,筛选到在胶质母细胞瘤样本中存在差异表达的七种趋化因子基因(CCL2,CCL8,CCL18,CCL28,CXCL1,CXCL5和CXCL13)。通过Cox回归分析,鉴定了35个趋化因子mRNA水平与胶质母细胞瘤预后的关系,其中CCL18对GBM患者具有最高的风险指数(Hazard ratio,HR),即CCL18基因高表达的GBM患者总生存期更短,提示CCL18可作为GBM诊断与预后更准确的分子标志物。针对72份临床胶质瘤组织样本的检测结果表明,CCL18在恶性程度更高的胶质瘤组织中高表达,且其高水平的蛋白表达量与患者不良预后相关。该研究对比分析了所有趋化因子在胶质母细胞瘤中发挥的作用,揭示了趋化因子CCL18在评估胶质母细胞瘤预后中的重要应用,为寻找针对胶质瘤的诊断生物标志物和治疗靶点奠定了基础。
博士后高文青和博士研究生李媛媛为论文共同第一作者,李继喜教授和温州医科大学附属第一医院神经外科苏志鹏主任为论文通讯作者。复旦附属华山医院神经内科陈向军主任等给予了支持和帮助。该研究得到了国家自然科学基金及上海市科委等项目的资助。
原文链接:https://www.dovepress.com/getfile.php?fileID=80352