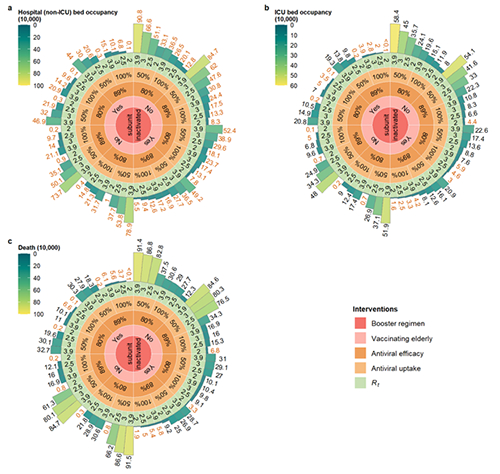
华中科技大学Nature子刊发现钠通道快速失活新机制
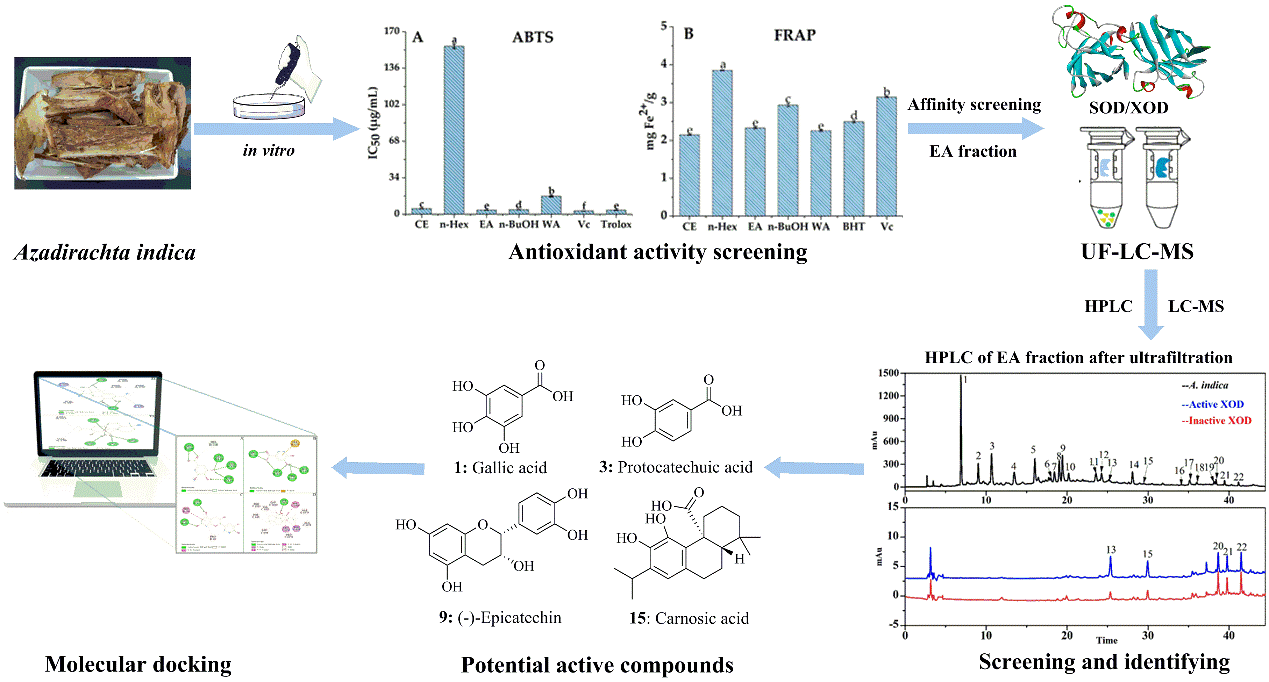
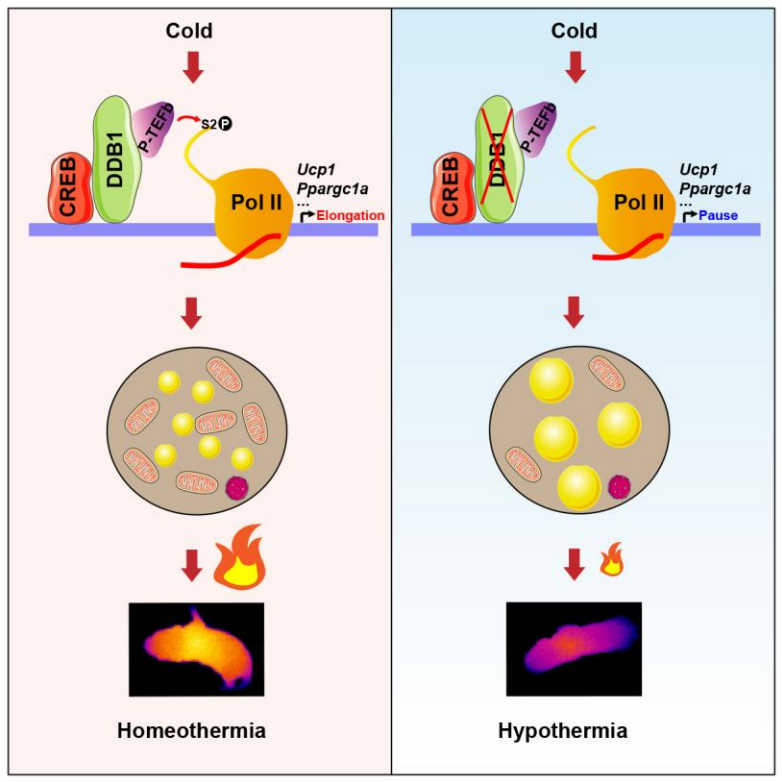
2022年5月17日,龚健科教授、姜道华研究员和黄卓教授合作,在Nature Communications杂志在线发表了题为“N-type fast inactivation of a eukaryotic voltage-gated sodium channel”的文章。该研究首次发现了真核生物球石藻Emiliania huxleyi钠通道NaVEh存在N型快失活门控机制,完全不同于高等动物钠通道中IFM基序介导的快失活。NaVEh的N端螺旋与中央腔门控之间存在多种静电相互作用,从而使N端螺旋插入并阻断已被激活的中央腔门孔,使其实现快速失活(图1)。
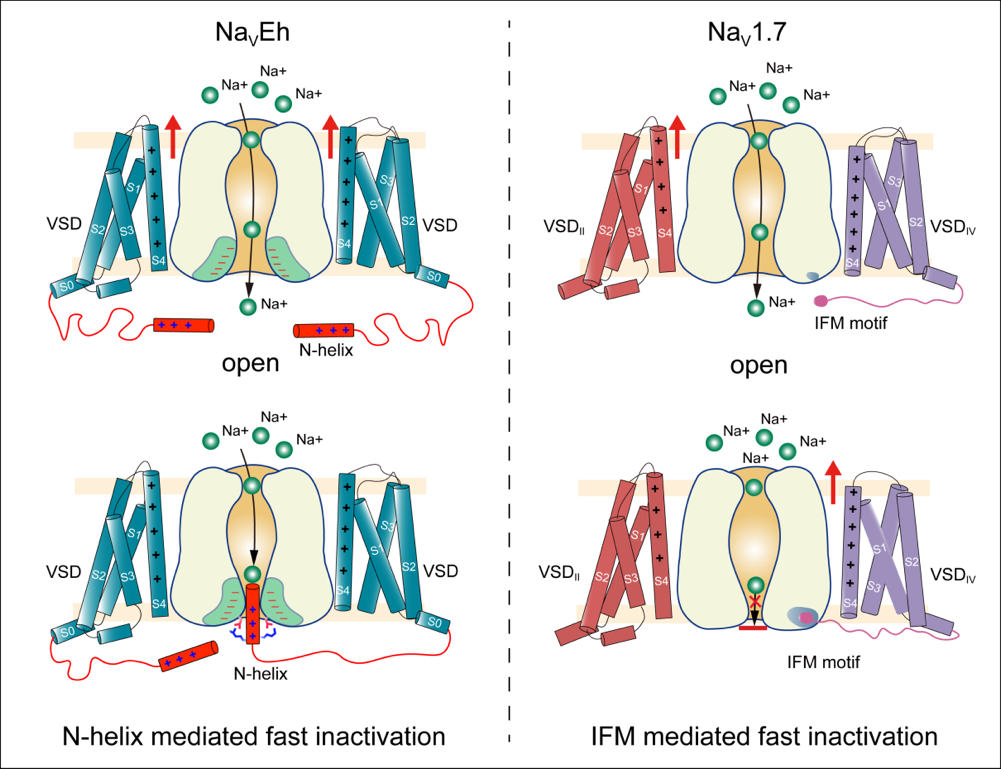
图1. 两种钠通道快速失活模式图
电压门控钠通道负责启动和传播动作电位,动作电位在高等生物神经信号传递、肌肉收缩、神经递质释放等多种生理进程中发挥至关重要的作用。通道的激活和失活对于调节细胞兴奋性至关重要,任一过程的功能障碍都会导致通道功能异常并可能导致危及生命的疾病。
真核生物的钠通道通常会在几毫秒内快速失活。目前真核钠通道结构研究表明,人源钠通道的Ile-phe-Met (IFM)基序可作为一个疏水性闩锁,以变构方式关闭激活门。相比之下,同源四聚体原核钠通道缺乏IFM基序,也没有快失活机制,而是具有数百毫秒内的缓慢失活。从进化的角度来看,在原核钠通道的慢失活和真核钠通道的快失活之间缺失了一环。
真核单细胞生物Emiliania huxleyi是海洋植物球石藻的一种,对海洋生态至关重要,并且与气候变化高度相关。其同源四聚体钠通道(NaVEh)缺乏快失活标志性元件IFM基序,但令人惊讶的是它与人类钠通道有相似的毫秒级别的快速失活特性。这就意味着真核生物可能存在有别于IFM介导的快失活机制以外未被揭示的新快失活机制。那么这类单细胞藻类的钠通道是如何实现快失活的呢?其钠通道进化过程中有什么未被揭示的奥妙呢?
研究人员利用单颗粒冷冻电镜技术解析了真核生物球石藻Emiliania huxleyi钠通道NaVEh蛋白分辨率2.8 ?的结构,首次揭示了钠通道存在N型快失活门控机制,完全不同于高等动物钠通道中IFM基序介导的快失活。NaVEh的 N端螺旋插入并阻断已被激活的中央腔门控,使其实现快速失活。
进一步的研究表明,是由于N端螺旋与中央腔门孔之间存在的多种静电相互作用导致的快失活的发生。N端螺旋(2-13位氨基酸)缺失或者带正电氨基酸(9-13位正电氨基酸)突变为负电氨基酸时会使NaVEh快速失活丧失。回补合成的N-螺旋多肽时,可以恢复NaVEh的快速失活。
此外,作者还发现,与哺乳动物钠通道显著不同的是,NaVEh从快速失活中恢复的速度比人NaV1.7慢约157倍。N-螺旋更强的结合相互作用导致从开放门释放N-螺旋的能量屏障将远高于IFM-基序从其受体位点释放的能量屏障,是导致其失活后恢复速率缓慢的主要原因。
总之,作者揭示了真核生物一种新颖的N-螺旋介导的钠通道快失活的详细分子机制,有助于更好的理解真核生物的钠通道。迷人的海洋植物球石藻对海洋生态至关重要,并且与气候变化高度相关。NaVEh的快速失活对于单细胞浮游植物耐受生活环境中高浓度的钠可能很重要,但缓慢的恢复可能会阻止这种机制在需要高频电信号的后生动物中使用。确定NaVEh的精确生理作用及其在球石藻和其他单细胞生物中独特的快速灭活过程将是非常有趣的。

华中科技大学为文章第一单位,华中科技大学龚健科教授、中国科学院物理研究所姜道华研究员和北京大学医学部黄卓教授为本研究论文的通讯作者。华中科技大学与中科院物理所联合培养博士研究生张江涛、北京大学硕士研究生侍一强、北京大学副研究员范俊萍和东北农业大学博士研究生陈慧文为共同第一作者。中国科学院生物物理研究所生物成像平台为本研究提供了设备和技术支持。本研究获得了国家脑科学与类脑智能技术项目、华中科技大学学术前沿青年团队项目、中国科学院战略性先导科技专项(B类)、国家自然科学基金委员会项目的资助。
相关论文信息:
(DOI: 10.1038/s41467-022-30400-w)