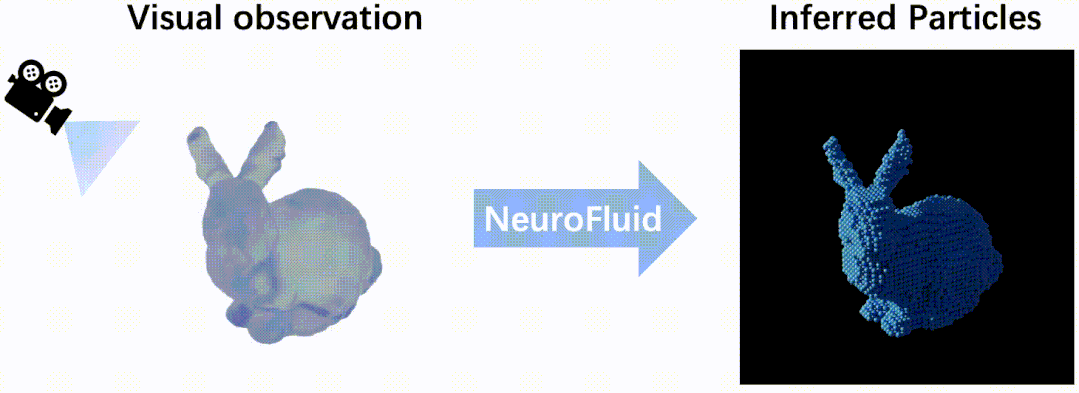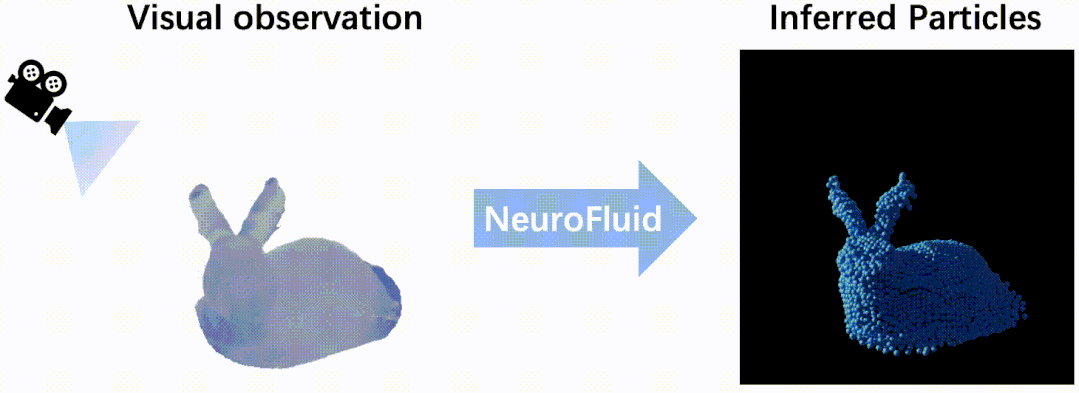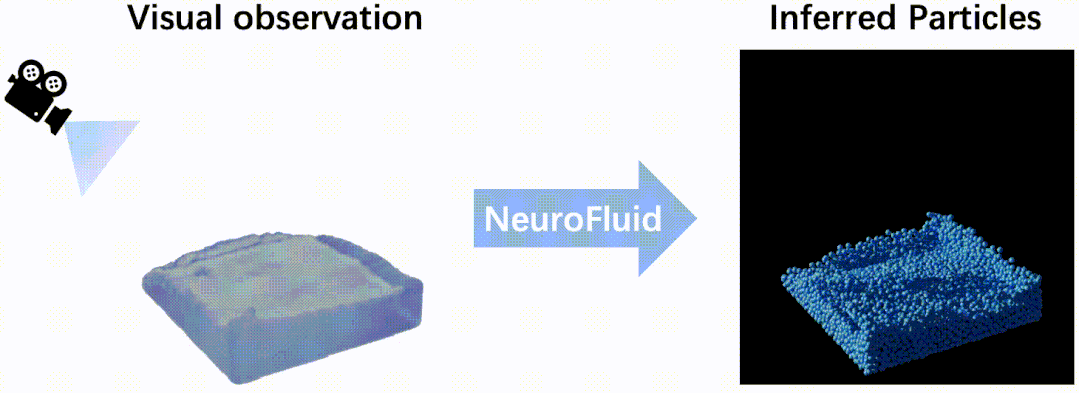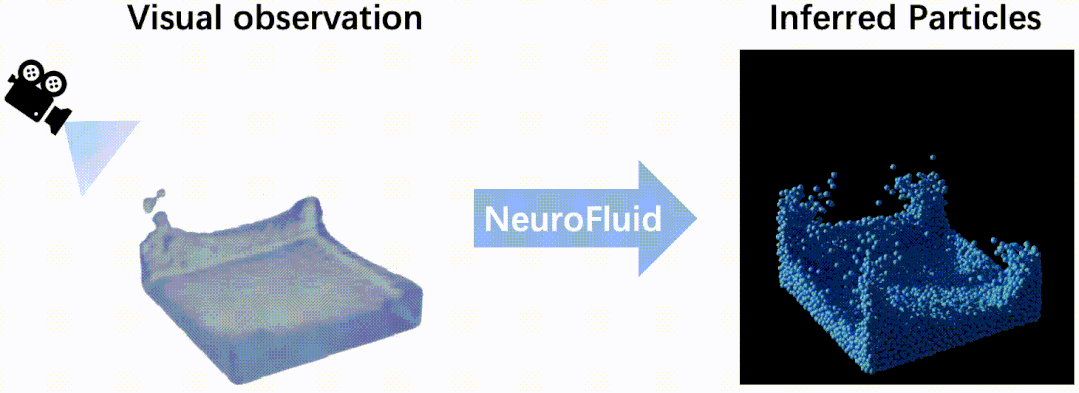
我院夏宁邵教授团队主持研制的鼻喷流感病毒载体新冠肺炎疫苗部分研究结果分别上线《科学通报》《柳叶刀·呼吸医学》
2022年5月26日,厦门大学、香港大学、北京万泰和中国食品药品检定研究院团队在国际学术期刊《科学通报》(Science Bulletin)在线发表了题为“A live attenuated virus-based intranasal COVID-19 vaccine provides rapid, prolonged, and broad protection against SARS-CoV-2”的研究成果,报告了鼻喷流感病毒载体新冠肺炎疫苗(以下简称“鼻喷苗”)的临床前研究及免疫机制研究结果。同日,江苏省疾病预防控制中心、厦门大学、中国食品药品检定研究院、江苏省东台市疾病预防控制中心和北京万泰团队在国际学术期刊《柳叶刀·呼吸医学》(The Lancet Respiratory Medicine)在线发表了该疫苗的I、II期临床研究结果,题为“Safety and immunogenicity of a live-attenuated influenza virus vector-based intranasal SARS-CoV-2 vaccine in adults: randomised, double-blind, placebo-controlled, phase 1 and 2 trials”。
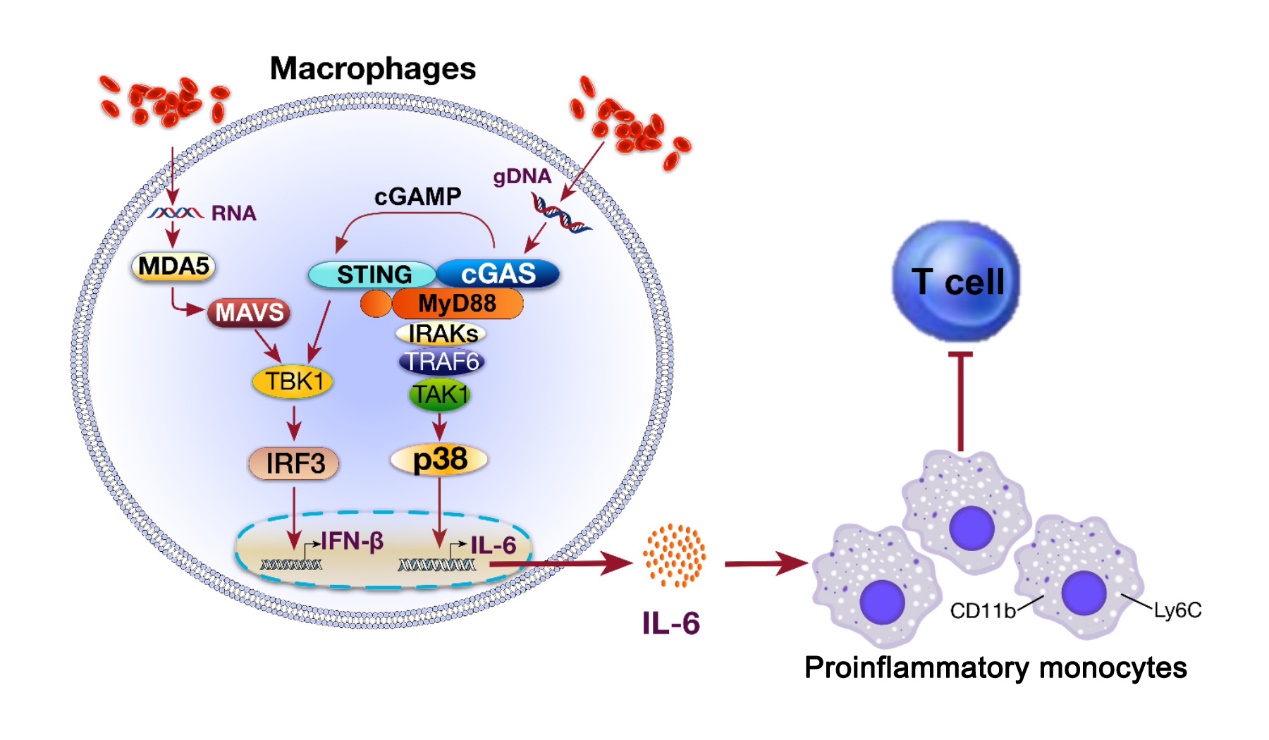
由厦门大学、香港大学和北京万泰联合研制的鼻喷流感病毒载体新冠肺炎疫苗是基于双重减毒的流感病毒载体开发出的携带新冠病毒RBD基因的可经鼻腔喷雾方式接种的疫苗CA4-dNS1-nCoV-RBD(简称dNS1-RBD),也是全球首个进入人体临床试验的鼻喷给药新冠肺炎预防性疫苗。该疫苗在重症新冠肺炎仓鼠模型中对多种变异株表现出快速且持久的保护效果,经鼻接种1天后即可快速起效,两剂次经鼻接种后可提供9个月以上的长效保护,表现为疫苗组仓鼠的体重未见明显下降、肺组织病理无明显损伤。该疫苗对Omicron等各种新冠病毒关切突变株均有广谱作用。另外,小鼠实验显示该疫苗还可广谱保护H1N1和H5N1流感病毒感染。与肌肉注射疫苗不同,该疫苗诱导的免疫应答以呼吸道局部细胞免疫及先天免疫为主,应答强度远高于外周血液应答,保护机制涉及呼吸道局部的先天免疫应答、T细胞应答、粘膜IgA抗体应答和体液IgG抗体应答等。
鼻喷苗I、II期和拓展临床试验分别于2020年9月、2020年11月以及2021年7月在江苏东台启动,均采用单中心、随机、双盲、安慰剂对照试验设计,受试对象为18岁及以上健康志愿者,全程接种为两剂次(间隔14天)。三项临床试验累计入组1084例既往无新冠疫苗接种史的18-86岁志愿者,其中684例接种鼻喷苗,400例接种安慰剂,安全性评价结果均显示该鼻喷苗具有良好安全性:试验组总体不良反应发生率为19%(国内外文献报道其他已上市新冠肺炎疫苗的总体不良反应发生率介于29-100%之间),其中局部和全身不良反应发生率分别为8%和15%,主要症状包括流涕、鼻瘙痒、鼻塞、发热、头痛、疲倦乏力等。绝大多数不良反应为轻度症状,且在短期内自行恢复。所有受试者研究期内均未报告与疫苗相关的严重不良事件。
由于在I、II期临床试验中,试验组与对照组受试者于同室接种,室内空气中存在的疫苗株气溶胶造成了交叉污染,安慰剂组部分受试者因间接免疫也产生了特异性细胞免疫应答。在拓展临床试验中,研究者在维持盲态的情况下将两组分房间接种,成功避免了空气交叉污染,环境采样检测结果显示,在接种鼻喷苗的房间内空气与物体表面可检出疫苗株成分,而接种安慰剂的房间内无法检出。拓展临床试验中期分析结果显示,试验组受试者外周血中细胞免疫应答率为40%,显著高于安慰剂组(1%,p<0.0001)。试验组血清IgG抗体与鼻咽拭子IgA抗体阳转率分别为22%和13%,而安慰剂组均无一受试者出现阳转。鼻喷苗在拓展临床试验中展现的免疫应答规律与临床前动物实验中一致。此外,鼻喷苗免疫原性评价结果显示60岁及以上受试者可产生与18-59岁受试者相当的免疫应答水平,且接种前的预存流感抗体并不影响接种后的免疫效果。
虽然临床前动物实验证实该鼻喷苗可在肺部诱导产生近百倍于外周血强度的细胞免疫应答,但受限于临床试验中无法采集人体肺部标本,无法直接获知肺部的免疫应答情况。类似的情况此前也曾在欧美上市近20年的流感鼻喷疫苗中被关注到。由阿斯利康公司生产的季节性流感鼻喷式疫苗FluMist?于2003年由美国FDA批准2-49岁人群使用,该疫苗也是目前美国FDA唯一批准的同类产品。在一项103名18-45岁成年人体攻毒试验中,FluMist?表现出的抗体应答率和抗体水平均不高于安慰剂,并且均显著低于流感灭活疫苗,然而却表现出比流感灭活疫苗更高的保护性[1]。在该研究中,对于三种不同型别的流感病毒A/H1N1、A/H3N2和B/Harbin,FluMist?组的HI抗体应答率分别为23%、33%和3%,鼻洗液IgA抗体分别为14%、32%和18%;而流感灭活疫苗对照组的HI抗体应答率分别为91%、76%和76%,鼻洗液IgA抗体分别为23%、17%和17%。以不同型别流感病毒株攻毒感染志愿者,FluMist?组对于三种流感型别的保护性分别为80%、78%和100%,而肌肉注射灭活疫苗的保护作用分别为60%、67%和100%。
鼻喷式疫苗可在呼吸道病毒感染的第一防线构建免疫屏障的特点及其友好的接种方式使其具有极大的应用潜力,但一直未被广泛开发及使用,人们对其作用机制和免疫效应指标的了解极少,使该类疫苗的研发面临极大挑战。本次发表的这两项研究结果提示鼻喷流感病毒载体新冠肺炎疫苗在成年人中具有很好的安全性并可有效诱导免疫应答,目前该疫苗正在菲律宾、南非、越南、哥伦比亚进行大规模III期临床试验以直接验证其对新冠肺炎的保护效果,以期对当前已大量使用的肌肉注射新冠肺炎疫苗形成良好互补,助力全球新冠肺炎疫情的防控。
在上述《科学通报》论文中,厦门大学公共卫生学院陈俊煜,香港大学医学院王培,厦门大学公共卫生学院袁伦志、张良,厦门大学生命科学学院张丽敏,中国食品药品检定研究院赵慧,厦门大学生命科学学院陈聪洁、王熹婧,北京万泰生物药业股份有限公司韩金乐,厦门大学公共卫生学院陈耀德为该论文共同第一作者,厦门大学夏宁邵,香港大学陈鸿霖,厦门大学陈毅歆,香港大学朱华晨,厦门大学张军,中国食品药品检定研究院李长贵,厦门大学张天英,北京万泰生物药业股份有限公司叶祥忠,厦门大学吴婷为该论文的共同通讯作者。该研究得到国家重点研发计划(2020YFC0842600)、国家自然科学基金委员会(82041038、81871651、81991491)、福建省科技厅(2020YZ014001)的经费资助。
在上述《柳叶刀·呼吸医学》论文中,江苏省疾病预防控制中心朱凤才,厦门大学公共卫生学院庄春兰,江苏省疾病预防控制中心储凯,厦门大学公共卫生学院张良,中国食品药品检定研究院赵慧为共同第一作者。江苏省疾病预防控制中心朱凤才,厦门大学夏宁邵、张军、吴婷,中国食品药品检定研究院李长贵,北京万泰生物药业股份有限公司叶祥忠,厦门大学张天英、陈毅歆为共同通讯作者。该研究得到国家重点研发计划(2020YFC0842600)、国家自然科学基金(31730029、82041038)、福建省自然科学基金(2020J06007)、中国医学科学院创新单元项目(2019RU022)和北京万泰生物药业股份有限公司的经费资助。
参考文献:
[1] Treanor JJ, Kotloff K, Betts RF, et al. Evaluation of trivalent, live, cold-adapted (CAIV-T) and inactivated (TIV) influenza vaccines in prevention of virus infection and illness following challenge of adults with wild-type influenza A (H1N1), A (H3N2), and B viruses.Vaccine. 1999;18(9-10):899-906. doi:10.1016/s0264-410x(99)00334-5
原文链接:
The Lancet Respiratory Medicine:
https://www.thelancet.com/journals/lanres/article/pIIS2213-2600(22)00131-X/fulltext
Science Bulletin:
https://www.sciencedirect.com/science/article/pii/S2095927322002250?via%3Dihub
(图/文国家传染病诊断试剂与疫苗工程技术研究中心)