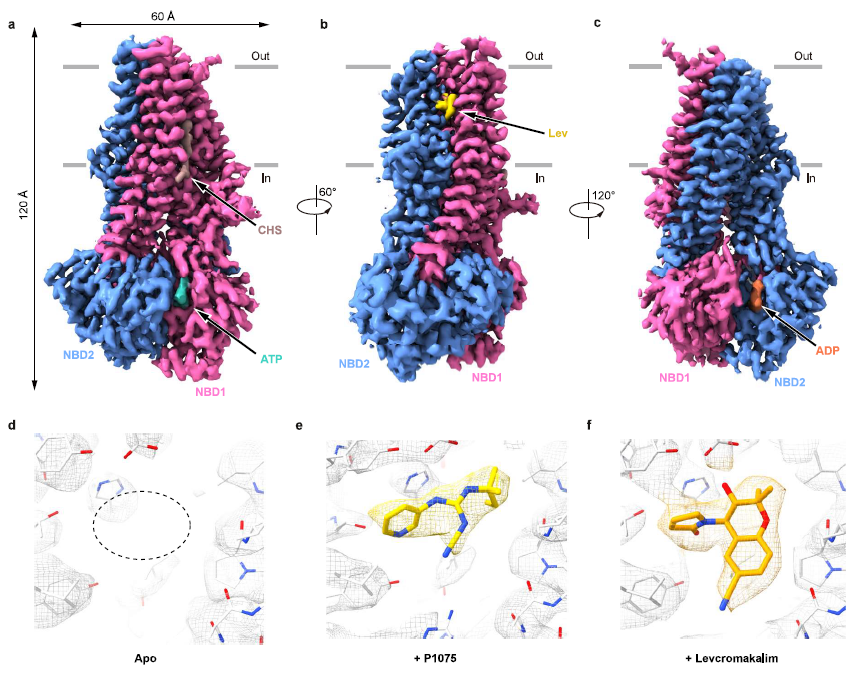
刘志博课题组报道水合电子介导的放疗激活前药策略
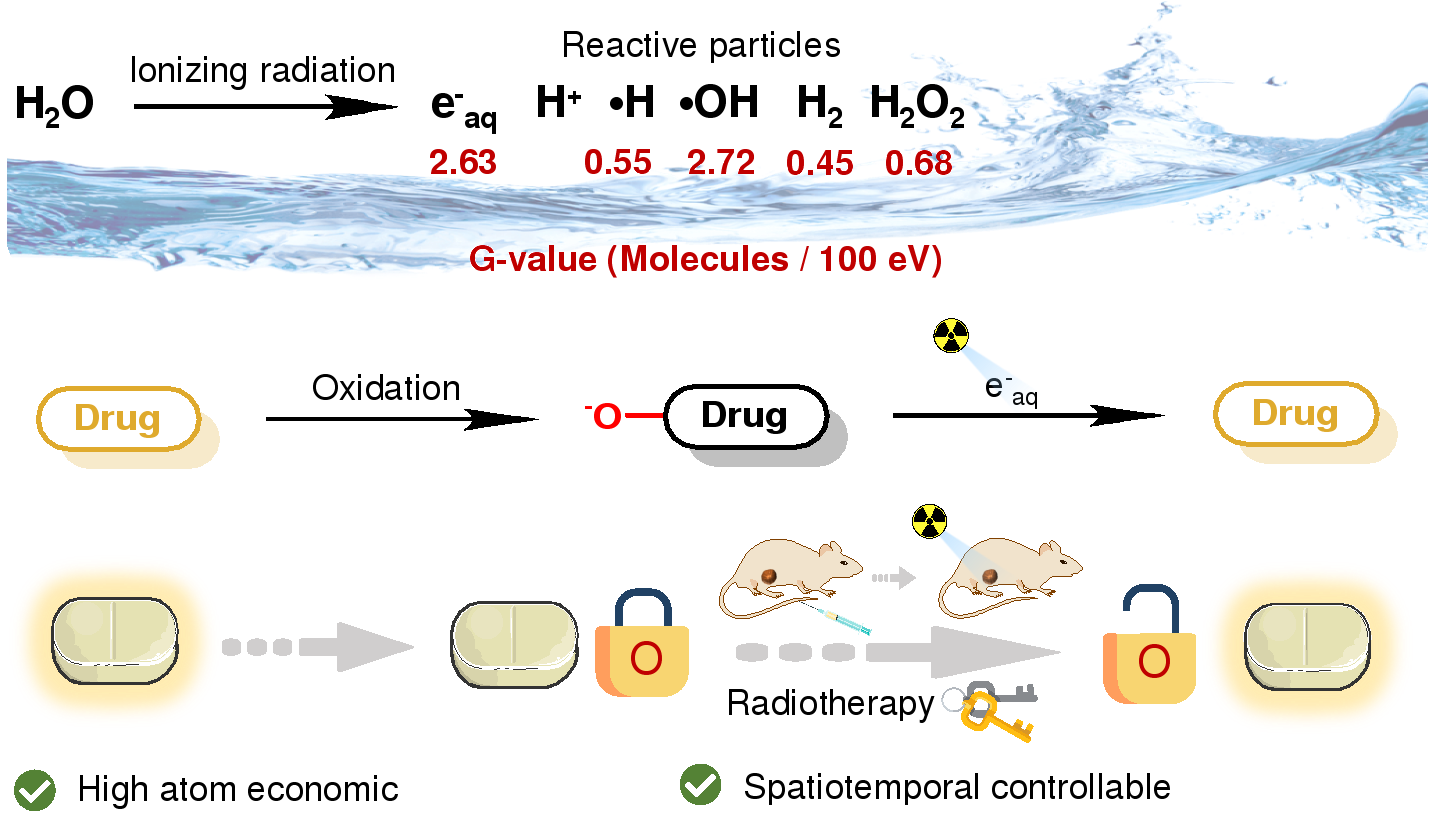
近日,北京大学化学与分子工程学院应用化学系刘志博课题组在Journal of the American Chemical Society上发表题为“Radiotherapy Reduces N-Oxides for prodrug Activation in Tumors”的研究论文。该研究发现,临床放疗剂量的核辐射能够在试管、活细胞和活体肿瘤中将氮氧化物(N-oxide)高效还原为对应的三级芳香胺或芳香杂环化合物。作者利用该反应,成功实现了放疗驱动的肿瘤选择性氮氧化物前药激活。
放疗射线还原氮氧化物实现肿瘤选择性前药激活
在临床中,联合放化疗是超过50%癌症病人的一线治疗方案。但是,受限于传统化疗药物较强的毒副作用,治疗效果有待提高。发展肿瘤选择性的化疗前药激活策略是解决上述问题的关键,同时也是药物研发领域一个长期存在的挑战。与其它激活手段相比,核辐射(如X射线、伽马射线等)能够精确地穿透深层组织,具有高时空分辨的优势,临床相关性也很强。水辐射分解可以产生多种活性化学物种,其中产额最高的是羟基自由基和水合电子。在2020年,刘志博研究员课题组首次报道了核辐活体剪切化学(Angew Chem Int Ed, 2020, 59, 21546),该工作是基于羟基自由基的原位氧化反应。随后,爱丁堡大学的Bradley课题组在2021年报道了基于氢自由基的辐射剪切化学(Nat Chem, 2021, 13, 805)。然而肿瘤的乏氧和还原性环境中水合电子的产额增加,发展水合电子介导的活体化学有利于提高前药激活的效率。
作者发现辐射产生的水合电子能够在试管和活细胞环境中还原氮氧化物为对应的三级胺。作者设计并合成了不同结构类型的氮氧化物,包括芳香三级胺类、芳香杂环类、烷基类,发现该反应适用于具有较大共轭结构的芳香胺和芳香杂环氮氧化物结构,并通过理论计算对反应的机理进行了合理的预测。综合考虑到芳香氮杂环是多种药物的活性中心,作者设计并合成了一系列氮氧化药物,这类氮氧化前药只有一个氧原子即可屏蔽其活性,具有高原子经济性,并能够被放疗射线还原为原药。其中,抗肿瘤药物喜树碱(CpT)的氮氧化物被选择作为模型前药,在活细胞和活体中证明了放疗射线能够精准激活化疗前药,有效地抑制肿瘤生长,实现放疗驱动的放化疗联合治疗。综上,该工作开发了新型的活体反应化学工具,发展了化疗药物的精确释放策略,有望对肿瘤的放化联合治疗带来关键性突破。
北京大学化学与分子工程学院的博士后丁泽轩为该文的第一作者,刘志博为通讯作者。该工作得到了国家自然科学基金委、科技部、北京市重点研发专题、李革-赵宁生命科学青年研究基金、昌平实验室、北京分子科学国家研究中心、化学与分子工程学院以及北大-清华生命科学联合中心的资助。