BRD2介导RNA聚合酶II转录的功能机理
BRD2/3/4/T是哺乳动物细胞中BET蛋白家族成员,它们均包含两个保守的溴结构域和一个ET结构域,是多种疾病抑制剂的关键靶点。BRD4通过招募转录延伸因子pTEF-b调控polII的转录延伸在领域内广泛报道。但是BET家族成员BRD2如何调控pol II 转录,其与BET蛋白家族其它成员之间的功能关系尚不清楚。另一方面,BRD2对小鼠早期胚胎发育至关重要,然而BRD2在干细胞命运决定和分化中的调控机制依然未知。
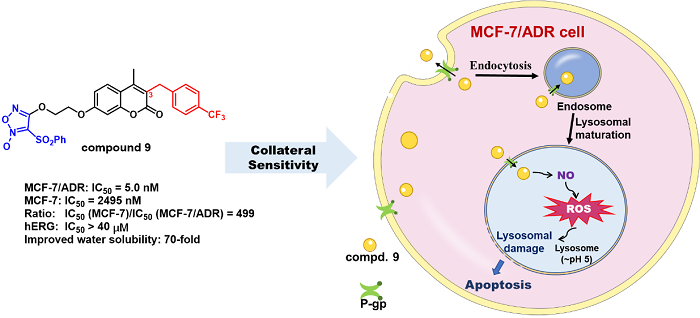
2022年6月4日,北京大学生命科学学院季雄研究员课题组在Cellular and Molecular Life Sciences杂志在线发表了题为“BRD2 interconnects with BRD3 to facilitate pol II transcription initiation and elongation to prime promoters for cell differentiation”的研究论文。该研究阐明了BRD2介导pol II的转录起始和延伸事件,BRD2与BRD3在基因转录过程中的相互作用关系,以及BRD2如何协调pol II转录起始为干细胞分化的蓄势待发做准备,鉴定了BRD2的直接调控靶基因。相关工作为特异性BET抑制剂的开发和应用提供了新见解。
在本研究工作中,作者建立了BRD2蛋白质瞬时降解胚胎干细胞系,结合多种技术手段分析发现BRD2蛋白降解导致不同基因的pol II转录起始和延伸障碍。进一步发现组蛋修饰H3K4me3低的区域,需要BRD2帮助转录起始因子TAF3招募;高丰度H3K4me3修饰的活跃转录区域,需要BRD2抑制转录延伸过程中R-Loop的形成。随后通过ChIp-seq实验,探讨BRD2、BRD3和BRD4之间的交叉调控关系。作者意外地观察到,BRD2降解会导致BRD3在特定基因启动子区域的结合增加,但是BRD2和BRD3在增强子和超增强子的占位存在协同占位。为了进一步研究BRD2和BRD3对pol II转录功能的影响,作者构建了BRD2/BRD3单降解和双降解细胞系,通过对不同BET蛋白的单独和组合调低后的pol II ChIp-seq测序结果的分析,提出BRD2和BRD3可以以协同、拮抗和独立三种方式调控pol II在不同基因上的转录。
基于上述发现,作者进一步利用小鼠胚胎干细胞体外分化和多组学技术探讨了BRD2调控pol II转录的生理意义。研究发现BRD2在不同发育阶段调控不同的基因:BRD2在干细胞阶段调控的基因与干细胞命运没有直接关系;然而BRD2在分化过程中调控分化相关基因的表达。这些分化基因在干细胞阶段有BRD2结合,BRD2降解后,相应基因启动子区域的pol II起始也发生变化,表明BRD2在干细胞分化过程中蓄势待发协调pol II转录起始。
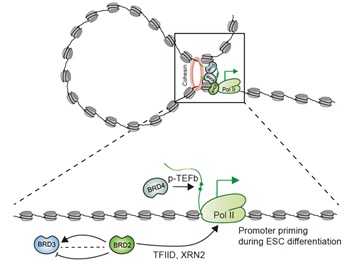
图1.BRD2介导pol II 转录调控的工作示意图
北京大学生命科学学院季雄和博士后黄捷是该论文的共同通讯作者。北京大学前沿交叉学科研究院博士研究生王晨璐和生命科学学院博士研究生许杞钦是该论文的共同第一作者。武汉大学生命科学学院陈亮课题组为该工作提供了重要帮助。该工作得到科技部国家重点研发计划、国家自然科学基金、北大-清华生命科学联合中心、细胞增殖与分化教育部重点实验室的资助。感谢北京大学凤凰工程多个仪器平台对本项目的大力支持。