Nature Communications |纤毛疾病相关蛋白参与纤毛“门控”维持和纤毛外泌体生成的机制
纤毛(Cilium)是动物细胞中高度保守的常见细胞器,其中央是微管形成的轴丝,外面包裹着富含多种受体的纤毛膜。纤毛作为凸起于细胞表面的“信号天线”,负责感受和传递细胞外的物理、化学和生物信号刺激,并可通过释放外泌体向细胞外发射信号。纤毛通过调控细胞的多种生命活动,对组织器官发育和稳态维持发挥作用。纤毛结构和功能异常引起一系列人类疾病,波及多种主要器官。临床表型包括但不限于:脑发育异常、内脏异位、先天性心脏病、多囊肾、肝纤维化、肥胖、视力损伤、生殖系统缺陷、多指/趾等症状。与纤毛异常相关的临床表型多以综合征的形式出现,例如:Meckel-Gruber综合征(MKS)、肾消耗病(Nephronophthisis,NpHp)、Joubert综合征(JBTS)、Bardet-Biedl综合征(BBS)和Oral-facial-digital综合征(OFD)等。目前临床上还没有针对纤毛相关疾病的治愈疗法。

纤毛基部与细胞体连接的部位,有一段结构特殊的区域,被称为纤毛过渡区(Transition Zone,TZ)。现在认为纤毛过渡区作为纤毛的“门”,保持纤毛蛋白在纤毛内富集。研究发现,很多纤毛疾病与纤毛基部过渡区(Transition Zone,TZ)超微结构异常相关,显示过渡区“门控”功能对人类健康的重要性。过渡区起筛选功能的超微结构主要由MKS复合体和NpHp复合体这两个大型蛋白复合体构成。研究这两个复合体如何装配、以及其中蛋白如何协同而又独立地调节纤毛组分和信号传递,将帮助我们了解纤毛相关疾病的发病机制,有利于纤毛相关疾病的药物研发。
7月9日,基础医学院病理生理学系曹木青课题组联合江苏师范大学王亮课题组,在Nature Communications期刊上发表了题为Ciliary transition zone proteins coordinate ciliary protein composition and ectosome shedding的研究论文。该研究综合使用生化细胞、蛋白组学、电子显微镜、超分辨成像等技术,阐明了纤毛过渡区以TCTN1为代表的MKS复合物、以NpHp4为代表的NpHp复合物,和过渡区/基体CEp290蛋白协同控制过渡区超微结构组装,调控纤毛内组分的分子机制;同时建立了过渡区与纤毛外泌体的联系,发现了过渡区对纤毛外泌体形成和释放的调节作用。该研究为纤毛疾病的发病机制研究提供了新的观点,提示纤毛外泌体异常可能与纤毛相关疾病发生有一定联系。
TCTN1编码的蛋白位于纤毛过渡区,其突变造成MKS和JBTS等纤毛疾病。目前已知TCTN1调控纤毛膜组分,进而参与纤毛信号的调节,而其具体的分子功能还不清楚。首先,研究人员使用透射电镜技术,发现TCTN1突变导致纤毛过渡区超微结构紊乱,尤其影响过渡区连接轴丝和纤毛膜的楔形结构,造成过渡区“门”结构的松散;同时,TCTN1蛋白缺失的纤毛出现肿胀,而且纤毛膜最外层的糖萼几乎消失。结合超分辨成像技术和免疫电镜技术,并对比CEp290和NpHp4的相对位置,研究人员发现TCTN1定位于过渡区中间段靠近纤毛膜的外围区域,提示MKS复合体和NpHp复合体构成了楔形结构的两端,分别结合外围纤毛膜和中间的微管轴丝,为过渡区的超微结构提供锚定支撑。
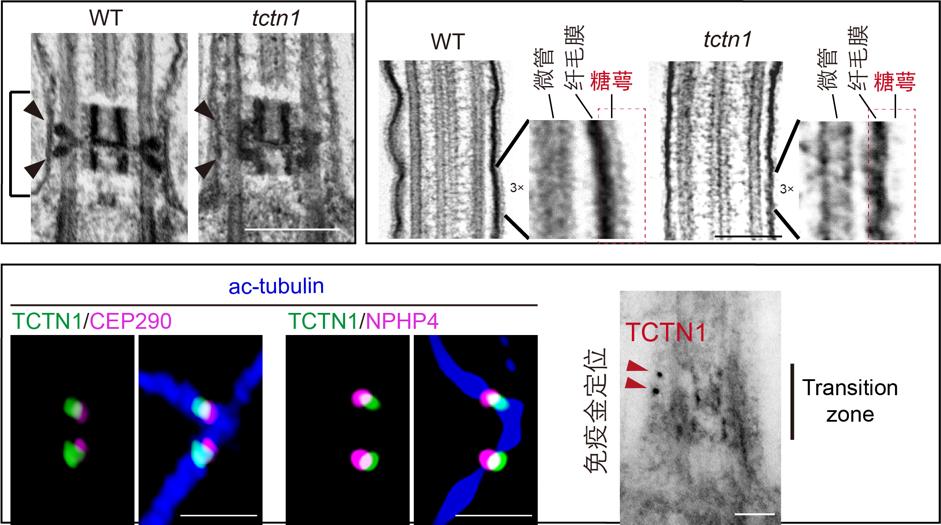
图1. TCTN1缺失对纤毛过渡区超微结构的影响
研究人员分离了野生型细胞,以及TCTN1、CEp290和NpHp4缺失突变体的纤毛,并使用蛋白质组学技术系统地对纤毛组分进行了分析比较。以往的研究发现,过渡区门控机制的异常,导致纤毛组分无法在纤毛内富集。惊奇的是,蛋白组学结果显示,过渡区异常,不但造成纤毛组分流失,而且还导致大量非纤毛蛋白质在纤毛内异常聚集,这些蛋白来源复杂,包括高尔基体,叶绿体,线粒体等来源的多种蛋白。蛋白组学数据还提示,纤毛外泌体相关蛋白在突变体纤毛中丰度异常。根据这一结果,研究人员对TCTN1、CEp290和NpHp4释放的纤毛外泌体进行了分析,证实了过渡区对纤毛外泌体的生成和活性的调控能力。总的来说,本研究系统性阐明纤毛过渡区不同蛋白复合体之间协同调节纤毛结构、纤毛蛋白组分、纤毛信号传导的一系列调控机制,从“纤毛过渡区—纤毛组分—纤毛外泌体”角度为纤毛疾病的发病机制提供了新的见解。
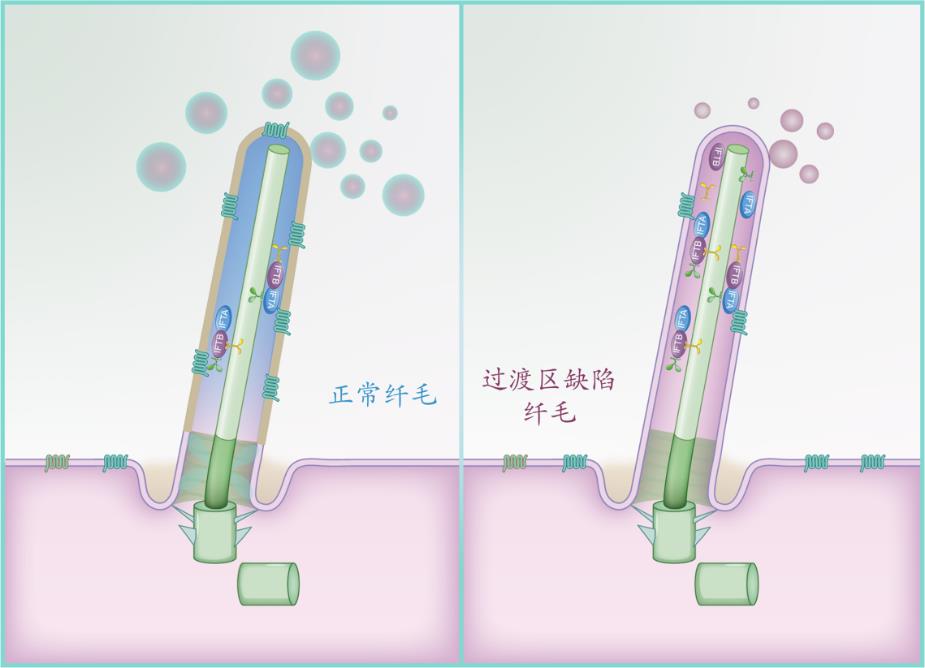
图2.“纤毛过渡区—纤毛组分—纤毛外泌体”调控模式图
上海交通大学医学院病理生理学系曹木青和江苏师范大学王亮为论文的通讯作者,清华大学潘俊敏教授对研究给予了极大的支持。该研究得到了国家重点研发计划,国家自然科学基金项目,江苏省自然科学基金项目,上海高水平地方高校创新团队,江苏高校优势学科建设工程等项目资助。