酶中的等电荷如何控制生化反应
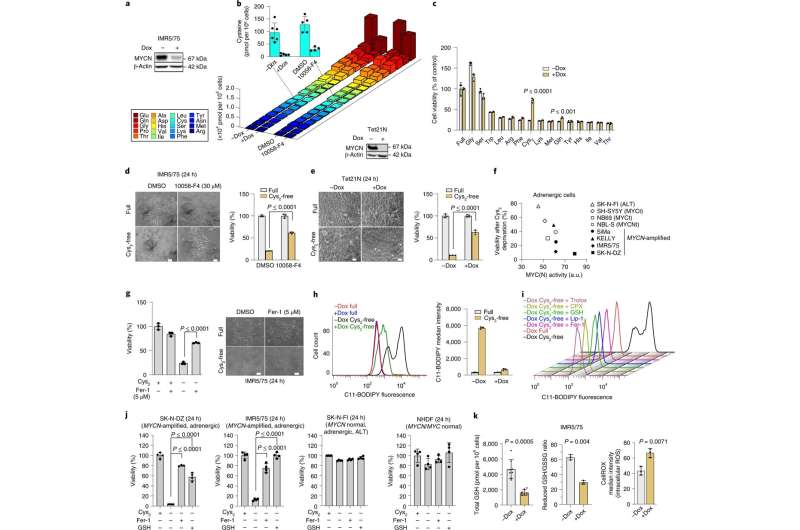
该团队研究了一种众所周知的酶,这种酶已经被广泛研究,是酶催化的教科书例子。没有酶,反应极其缓慢:事实上,一半的底物要花7800万年才能发生反应。这种酶仅仅通过在活性中心放置负电荷和正电荷,就能将这种反应加速1017倍。由于底物中含有一个带负电荷的基团,这个基团会以二氧化碳的形式分离出来,几十年来,人们一直认为酶的负电荷会对同样带负电荷的底物施加压力,从而加速反应。然而,由于反应的结构太快而无法观察到,这种假设的机制仍未得到证实。
G?ttingen分子生物科学中心(GZMB)的Kai Tittmann教授的团队现在首次成功地使用蛋白质晶体学获得了化学反应之前不久的底物的结构快照。出乎意料的是,酶和底物的负电荷并不相互排斥。相反,它们共享一个质子,这就像一种分子胶水,在吸引的相互作用中发挥作用。“在酶催化的背景下,两个相等的电荷是朋友还是敌人,这个问题在我们的领域一直存在争议,我们的研究表明,酶如何工作的基本原理仍然需要很长一段时间才能被理解,”Tittmann说。量子化学家里卡多·玛塔教授和他来自G?ttingen大学物理化学研究所的团队分析了晶体结构。“额外的质子,带正电荷,在两个负电荷之间,不仅用来吸引参与反应的分子,而且它触发了级联的质子转移反应,进一步加速了反应,”Mata解释说。
“我们相信这些新描述的酶催化原理将有助于开发新的化学催化剂,”Tittmann说。“由于我们研究的酶释放二氧化碳,这是人类活动产生的最重要的温室气体,我们的研究结果可能有助于开发新的化学策略来固定二氧化碳。”
哥廷根的科学家研究中心分子生物科学(GZMB)、生物学和心理学的教师,和哥廷根大学化学学院,以及马克斯·普朗克多学科科学研究所的欧洲分子生物学实验室(EMBL)汉堡和多伦多大学的。该出版物是为了纪念去年去世的合著者乌尔夫·迪德里希森教授。
Journal Reference:
Sören Rindfleisch, Matthias Krull, Jon Uranga, Tobias Schmidt, Fabian Rabe von pappenheim, Laura Liliana Kirck, Angeliki Balouri, Thomas Schneider, Ashwin Chari, Ronald Kluger, Gleb Bourenkov, Ulf Diederichsen, Ricardo A. Mata, Kai Tittmann. Ground-state destabilization by electrostatic repulsion is not a driving force in orotidine-5′-monophosphate decarboxylase catalysis. Nature Catalysis, 2022; DOI: 10.1038/s41929-022-00771-w