《Cell Stem Cell》科学家确定了胃主细胞转变为干细胞的分子开关
胃粘膜中被称为“主细胞”的特化细胞通常会产生消化酶,但当胃粘膜受损时,这些成熟的成体细胞会迅速戴上它们的干细胞帽,迅速繁殖,再生受损的组织,恢复平衡状态。支撑这一戏剧性转变的分子机制直到现在才为人所知。
由奥地利科学院(IMBA)分子生物技术研究所的科学家领导的一项新的小鼠研究,现在已经确定了主要细胞这种储备干细胞状态的分子开关。研究人员发现,在正常状态下,一个名为p57的基因开关在主细胞中不断产生,但在受伤后,它的表达急剧下降,随后是主细胞的快速增殖。
“我们知道这种行为必须依赖于一个开关,我们的目标是揭示它的精确机制,”Bon-Kyoung Koo博士说,他是IMBA的一名研究员,也是该研究的通讯作者。
这项研究结果发表在《Cell Stem Cell》杂志。
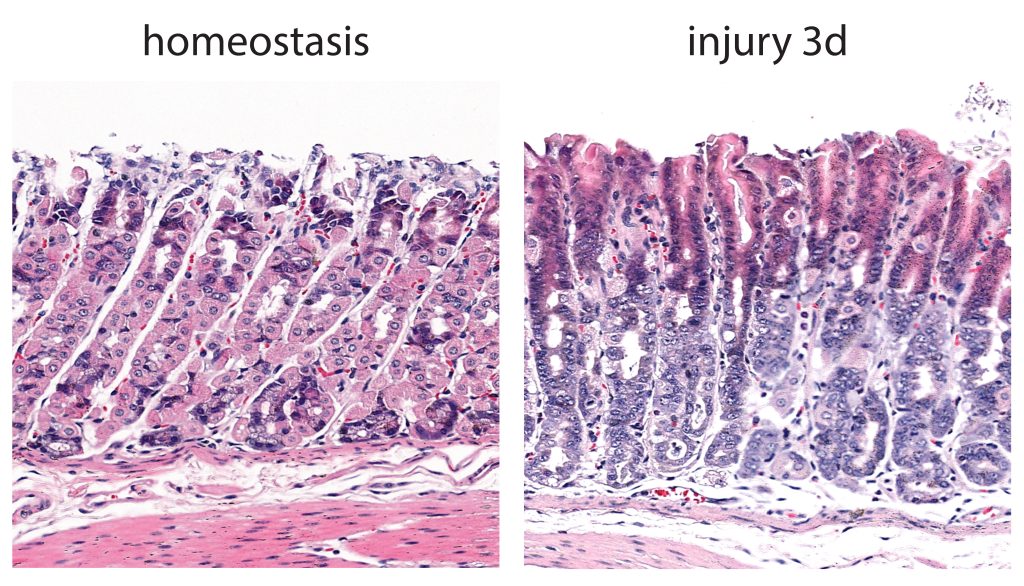
与美国纳什维尔范德比尔特大学医学中心和韩国浦项科技大学(pOSTECH)的合作者一起,科学家们开发了一个小鼠模型,以追踪胃组织损伤对主要细胞的影响。通过单细胞RNA测序和强力霉素诱导的细胞系追踪,研究人员证实p57的缺失先于主细胞系增殖的触发。
“我们确定了一个分子,p57,是我们一直在寻找的潜在分子开关,”Bon-Kyoung Koo实验室的博士后研究员、本研究的主要作者Ji-Hyun Lee博士说。“我们证实,受伤后,主细胞中的p57水平迅速下降,随后是主细胞谱系中的增殖高峰。”
在从胃主体培养的类器官(类器官体)中,研究人员发现,人工提高p57表达可以诱导长期储备干细胞状态,改变对周围环境的需求,并增加酶分泌。这表明,胃类器官中p57的高水平使储备干细胞表现得更像成熟的、不能繁殖的分泌主细胞。

科学家们还发现,如果他们通过诱导p57基因的连续或稳定表达来阻止主细胞p57表达的下降,它们的增殖能力和对损伤的反应能力就会受损。
“类器官通常是高度增殖的,因为它们在培养中需要生长因子鸡尾酒。然而,一旦我们引入p57,类器官突然停止生长,”Lee说。“在第二步中,我们减少了p57的表达,让我们高兴的是,类器官开始再次增殖。这意味着细胞并没有因为p57而失去其干细胞性。它们只是进入了一种储备状态,完全模仿了我们在体内的观察。”
研究小组总结说,p57扮演着守门人的角色,当内环境平衡因受伤而被破坏时,它将备用干细胞状态强加给主细胞。
p57Kip2 imposes the reserve stem cell state of gastric chief cells