我院分子影像中心郭志德团队开发了一种基于2-[18F]FDG和PD-L1抗体联合的癌症免疫治疗范式用于提高抗肿瘤效果
近年来,免疫治疗在临床的成功应用开启了癌症治疗的新阶段,其中,免疫检查点抑制剂pD-1/pD-L1, CTLA-4在目前研究最为广泛。尽管免疫检查点抑制剂使得小部分患者明显获益,延长生存周期,但其治疗的响应率在大多数患者中不足30%,仍然限制了其广泛的临床应用。
近日,我院郭志德老师、张现忠教授和新加坡国立大学陈小元教授在Clinical Cancer Research上发表了题为“A paradigm of cancer immunotherapy based on 2-[18F]FDG and anti-pD-L1 mAb combination to enhance the anti-tumor effect”的研究性论文,报道了一种基于2-[18F]FDG和anti-pD-L1抗体联合的癌症免疫治疗新范式。作为临床应用最广泛的pET示踪剂,全球每年有数千万例的肿瘤患者需要用到2-[18F]FDG的pET显像进行辅助诊断。虽然,2-[18F]FDG-pET成像在肿瘤检测、疗效评估等方面中发挥着突出的作用,但作为免疫调节剂调节免疫检查点受体表达、增强免疫治疗效果的能力从未被考虑。我们在研究中偶然发现,2-[18F]FDG作为一种潜在的免疫调节剂,可以诱导肿瘤细胞表面pD-L1表达的改变,为肿瘤免疫治疗创造更有利的免疫微环境。如能将其用于癌症的免疫联合治疗,将使得更多的癌症患者受益。

基于该发现,该研究团队首次将2-[18F]FDG与anti-pD-L1抗体联合使用,用于放射性配体与免疫检查点抑制剂联合治疗肿瘤。首先,研究人员通过流式细胞术,免疫荧光实验,RT-qpCR等一系列体外实验验证了多种肿瘤细胞表面的pD-L1表达水平在经过2-[18F]FDG刺激后均明显上调,且通过转录组学研究揭示了在该过程中多个与pD-L1相关基因的上调以及一些可能的信号通路改变。通过克隆聚集实验及检测DNA损伤发现即使较高剂量2-[18F]FDG的参与也不会造成大多数肿瘤细胞的死亡,但会有明显的DNA损伤及损伤后修复的过程发生。为探索2-[18F]FDG与pD-L1上调的内在关联,该团队通过western blot研究证明了NF-κB和 IRF3信号通路的激活,并且验证了DNA损伤后修复的过程可以通过激活NF-κB和 IRF3信号进而上调pD-L1的表达。除此之外,该研究还证明了DNA损伤后pD-L1的上调也通过STAT1/3-IRF1通路介导。
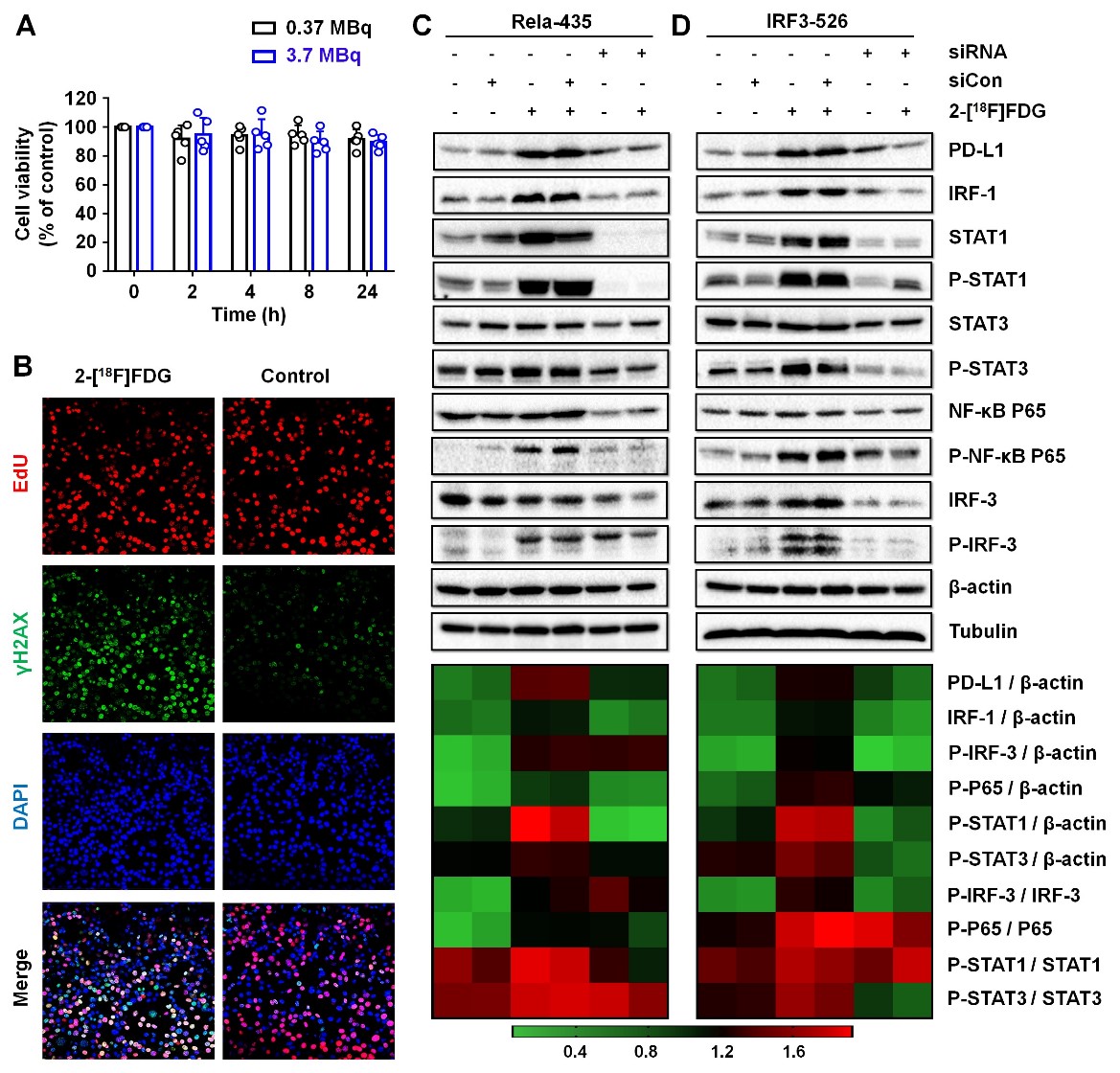
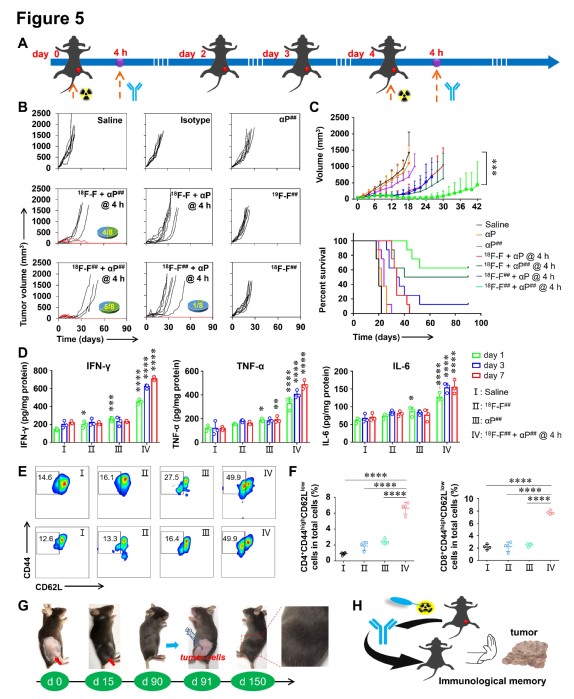
既然2-[18F]FDG可以造成肿瘤细胞表面pD-L1表达的改变,那么是否可以增加anti-pD-L1抗体的摄取?该团队通过pET显像,免疫组化,流式细胞术等一系列体内外实验验证了2-[18F]FDG上调的pD-L1表达可以增加pD-L1抗体在肿瘤部位的摄取。基于此,将示踪剂2-[18F]FDG与anti-pD-L1抗体联合进行免疫治疗将有可能增强抗pD-L1免疫治疗的效果。研究结果表明,在合适的剂量(18.5 MBq 2-[18F]FDG)和4小时时间窗的条件下,该联合策略可以对MC38肿瘤鼠产生明显的肿瘤抑制效果,且有50%以上的肿瘤在监测周期内消失且在对侧接种相同类型的肿瘤也无明显生长,监测至150天内均无复发的迹象,证明了该联合治疗策略不仅有强大的抗肿瘤效果,且可以产生免疫记忆,防止肿瘤的复发。治疗过程中对肿瘤微环境进行检测,发现在联合治疗组中,CD8+杀伤性T细胞,CD4+辅助杀伤性T细胞的比例显著增加,而FOXp3+的抑制性T细胞比例显著降低。此外M1型巨噬细胞和树突状细胞的比例相对生理盐水组也有明显的增加,而抑制性的M2型巨噬细胞和髓源性抑制细胞的比例明显降低。证明了该联合治疗方式重塑了肿瘤微环境,使其由“冷”变“热”,同时增强了低免疫原性肿瘤的敏感性,提高了其对pD-L1抗体治疗的响应率。
该研究将核医学成像示踪剂2-[18F]FDG作为免疫调节剂来增强anti-pD-L1抗体免疫治疗并取得出乎意料的效果,为诊断型核素与免疫治疗的联合应用提供了一种新的范式。我院郭志德老师、张现忠教授和新加坡国立大学陈小元教授为该文章的共同通讯作者,我院博士生文雪君为该文章的第一作者,该研究得到了国家自然科学基金、厦门大学南强青年拔尖人才项目、厦门大学校长基金等项目的资助。
(分子影像中心)






























