我国学者在艰难梭菌感染的致病机制研究方面取得进展
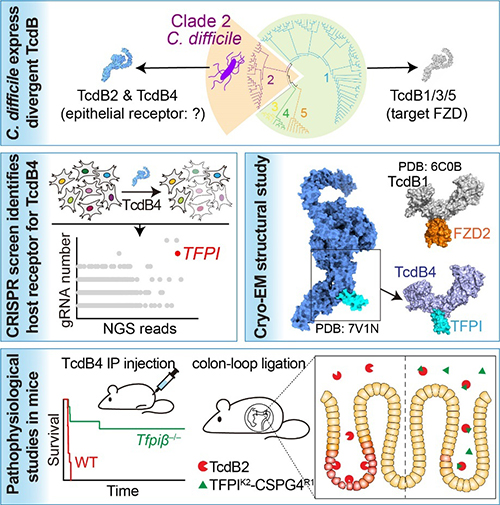
图 TFpI是超毒力艰难梭菌毒素B的肠道上皮受体
在国家自然科学基金项目(批准号:31970129、31800128、32171205)等资助下,西湖大学生命科学学院陶亮团队与施一公团队合作,在艰难梭菌(Clostridium difficile)感染的致病机制的研究方面取得突破。相关成果以“TFpI是超毒力2型分支艰难梭菌外毒素B的结肠隐窝受体(TFpI is a colonic cryptic receptor for TcdB from hypervirulent clade 2 C. difficile)”为题,于2022年3月17日在线发表在《细胞》(Cell)期刊上。论文链接:https://www.cell.com/cell/fulltext/S0092-8674(22)00181-7。
艰难梭菌感染是社区和临床最常见的病原菌感染之一,也是全球性的公共健康问题。艰难梭菌中的2型进化分支由于其高致病性又称为超毒力分支,病症严重且致死率较高,在北美和欧洲地区曾造成数次爆发性感染。与其它分支的艰难梭菌不同,超毒力分支的艰难梭菌专有表达两种TcdB亚型(TcdB2和TcdB4),且都不识别经典的TcdB上皮细胞受体FZD蛋白,其如何靶向肠道上皮细胞是一个困扰本领域多年的重要问题。
该研究中,研究者们通过CRISpR筛选找到了一系列和TcdB4相关的细胞因子候选基因。之后通过生化和细胞学实验,鉴定并验证了TFpI分子是介导超毒力分支艰难梭菌TcdB进入细胞的关键受体。接下来,通过冷冻电镜的手段解析了TcdB4和TFpI的复合物结构。有趣的是,TcdB4识别TFpI的互作界面与TcdB1识别Frizzled的界面高度重合,显示了毒素分子内一个进化上保守的受体识别区域。之后利用构建TFpI部分敲除小鼠模型,证明TFpI是介导超毒力分支艰难梭菌TcdB在体内与病理相关的受体,而肠道隐窝和肾脏由于高表达TFpI是TcdB2/4攻击的主要靶向部位。利用小鼠结肠结扎模型,融合的TFpI-CSpG4蛋白分子可以在体内有效阻止超毒力分支艰难梭菌TcdB对肠上皮的破坏,展现了用于临床预防和治疗的潜力(图)。该研究对于揭示和理解艰难梭菌感染的致病机制及细菌毒素的进化和工作方式有着重要科学意义,并且为超毒力分支菌株引起的艰难梭菌感染预防和治疗新方法的开发提供了重要的理论依据。






























