Nat Commun | 上海药物所徐华强课题组合作破解甲酰肽受体模式化识别甲酰肽的保守机制
2022-03-05 00:00:00
来源:网络整理
甲酰肽是一类在氨基末端(N末端)具有甲酰化甲硫氨酸的多肽分子,是一种普遍存在的病原相关分子模式(pAMp)或损伤相关分子模式(DAMp)。甲酰肽受体 (FpRs)家族作为一类模式识别相关G蛋白偶联受体 (GpCR),能够特异性识别来源于入侵病原体或宿主受损线粒体中的甲酰肽,在人体固有免疫中扮演重要角色。FpRs由三个成员组成,包括FpR1、FpR2(也称为FpRL1)和FpR3,这些受体主要分布于中性粒细胞、嗜酸性粒细胞、巨噬细胞和树突状细胞等免疫细胞中,被甲酰肽激活后,一方面诱导中性粒细胞、肥大细胞等激活,释放炎症细胞因子,促使炎症发生;同时,作为趋化物招募巨噬细胞等快速富集,引起活性氧的产生消灭病原微生物,并对病原体以及受损组织进行吞噬清除,在免疫防御和调节过程起重要作用。FpRs与趋化因子受体、过敏毒素受体(C5aR1),类二十烷脂质分子白三烯B4和前列腺素D2(BLT和CRTH2)受体一起构成Gi偶联的趋化因子受体家族,分属于A类GpCR的γ分支,主要通过偶联G蛋白家族中的Gi/o异源三聚体介导信号传递。 FpR1和FpR2在氨基酸序列上高度相似,然而,两者显示出不同的甲酰肽偏好性。FpR1倾向于高亲和力结合短甲酰肽,例如典型的甲酰肽fMLF (N-formyl-Met-Leu-phe),而FpR2偏向结合较长的肽或具有特定序列的肽,例如酚溶性调节蛋白α(pSMα),一种金黄色葡萄球菌产生的甲酰肽毒素。大量研究发现,FpR1和FpR2,尤其是FpR2,表现出明显的配体杂乱性,除了能够模式化识别广泛来源的甲酰化多肽配体外,还可以识别一系列结构和功能不一样的非甲酰化蛋白或脂质配体,包括血清淀粉样蛋白A (SAA)、HIV病毒来源多肽、鼠疫病原体耶尔森氏菌的致病毒素、β淀粉样蛋白以及脂质配体LXA4和Resolving D1等,表现出促进炎症或抗炎效应。开发偏向性激活FpR2消炎信号通路的激动剂药物是目前靶向哮喘、阿尔兹海默症以及心脑血管疾病等药物研究领域的热点和前沿。 前期,上海药物所徐华强课题组通过冷冻电镜技术解析并报道了首个甲酰肽受体FpR2结合多肽配体WKYMVm的近原子分辨率结构,结合多种实验方法揭示了FpR2的配体正性结合口袋特性以及配体识别多样性的可能结构因素(庞大的配体结合口袋以及构象活跃的胞外结构域),阐释了FpRs受体家族识别甲酰肽的潜在的保守识别模式。为进一步确证FpRs识别甲酰肽的保守机制以及配体结合多样性分子机制,科研团队与美国匹兹堡大学张诚课题组合作,解析了甲酰肽fMLFII激活下FpR1-Gi和FpR2-Gi信号复合物,以及抗炎多肽CGEN-855A和化合物Compound 43结合FpR2-Gi复合物的冷冻电镜结构(2.9埃 - 3.2埃),并结合细胞水平功能分析揭示了甲酰肽识别并激活FpRs的保守模式,阐述了FpR1和FpR2结合不同长度甲酰肽的选择性决定因素等,为深入了解甲酰肽受体家族的配体识别和激活机理以及靶向FpRs理性药物设计提供了重要的结构基础和理论依据。研究论文“Molecular recognition of formylpeptides and diverse agonists by the formylpeptide receptors FpR1 and FpR2”于2月25日在线发表于国际知名期刊Nature communications。 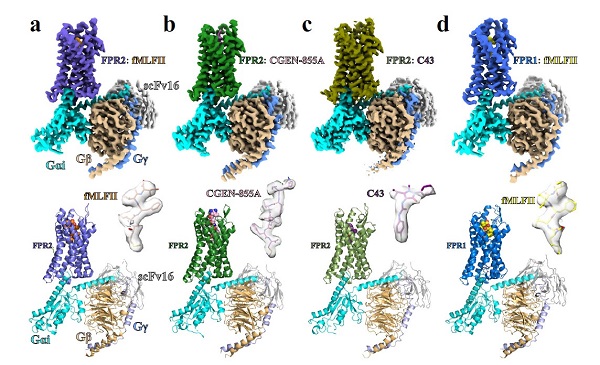 图1. 不同配体结合下FpR1-Gi以及FpR2-Gi信号复合物的冷冻电镜密度图和三维结构模型。 研究发现,甲酰肽fMLFII以N端朝口袋内部的方式结合到FpR1和FpR2上,与科研人员前期用计算机模拟得出的结论一致。结构比对发现,fMLFII在FpR1和FpR2中的结合模式高度相似,其N末端的甲酰基与FpR1/FpR2配体结合口袋内部保守的氨基酸残基D3.33, R5.38 和R5.42形成极性相互作用网络,这三个保守的氨基酸充当“钳子”的作用,将甲硫氨酸侧链以正确的构象定位到口袋底部由保守氨基酸W6.48 、p5.50、F6.44以及V3.40形成的狭窄的激活腔中,引起腔内氨基酸构象变化,进而激活FpRs,这表明FpR1/FpR2通过保守的模式识别甲酰肽。值得注意的是,保守激活腔内的氨基酸W6.48 、p5.50、F6.44以及V3.40是Class A 类GpCRs激活的关键基序。通过比较WKYMVm, 甲酰肽fMLFII, CGEN-885A以及Compound 43四种不同配体结合的FpR2结构发现,虽然这些配体在FpR2正性结合口袋的结合模式各异,但是三种多肽配体的C端/N端甲硫氨酸侧链以及Compound 43的氯苯基在保守激活腔中构象高度重合,并且均与保守氨基酸D3.33, R5.38 和R5.42形成极性相互作用网络,表明不同FpRs配体与甲酰肽配体共享上述相似的受体激活分子机制。
图1. 不同配体结合下FpR1-Gi以及FpR2-Gi信号复合物的冷冻电镜密度图和三维结构模型。 研究发现,甲酰肽fMLFII以N端朝口袋内部的方式结合到FpR1和FpR2上,与科研人员前期用计算机模拟得出的结论一致。结构比对发现,fMLFII在FpR1和FpR2中的结合模式高度相似,其N末端的甲酰基与FpR1/FpR2配体结合口袋内部保守的氨基酸残基D3.33, R5.38 和R5.42形成极性相互作用网络,这三个保守的氨基酸充当“钳子”的作用,将甲硫氨酸侧链以正确的构象定位到口袋底部由保守氨基酸W6.48 、p5.50、F6.44以及V3.40形成的狭窄的激活腔中,引起腔内氨基酸构象变化,进而激活FpRs,这表明FpR1/FpR2通过保守的模式识别甲酰肽。值得注意的是,保守激活腔内的氨基酸W6.48 、p5.50、F6.44以及V3.40是Class A 类GpCRs激活的关键基序。通过比较WKYMVm, 甲酰肽fMLFII, CGEN-885A以及Compound 43四种不同配体结合的FpR2结构发现,虽然这些配体在FpR2正性结合口袋的结合模式各异,但是三种多肽配体的C端/N端甲硫氨酸侧链以及Compound 43的氯苯基在保守激活腔中构象高度重合,并且均与保守氨基酸D3.33, R5.38 和R5.42形成极性相互作用网络,表明不同FpRs配体与甲酰肽配体共享上述相似的受体激活分子机制。 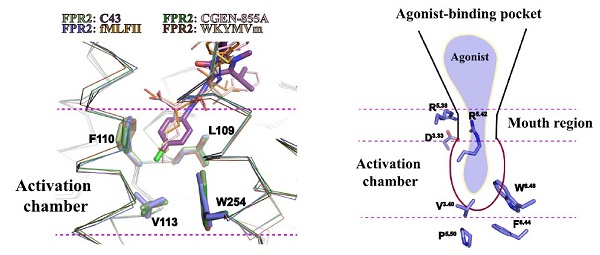 图2. FpRs配体的保守识别和激活机制。不同FpR2配体在保守激活腔内的构象高度重合(左图),通过与保守氨基酸D3.33, R5.38 和R5.42的极性相互作用,将特定基团定位到激活腔内,进而激活受体。 FpR1和FpR2对不同的甲酰肽具有结合的偏好性,研究结果表明,FpR1上的非保守氨基酸Y2576.51和F1023.29与甲酰肽形成更多的相互作用,相比于FpR2,FpR1的近胞外端结构更为狭窄,在空间上限制了长链甲酰肽与其结合,这些因素共同决定了FpR1偏好性识别短链甲酰肽而FpR2倾向于结合长链甲酰肽。 上海药物所副研究员庄友文、美国匹兹堡大学博士后Lei Wang为该论文的共同第一作者,上海药物所为第一单位。徐华强研究员、张诚教授为共同通讯作者。参加这项研究的还有上海药物所研究生郭嘉、王悦和刘卫一,以及匹兹堡大学博士后孙大鹏,其中,郭嘉在冷冻电镜样品制备和数据处理过程中做出了重要的贡献。此项工作得到了美国国立卫生研究院、科技部重点研发计划项目、中科院先导计划、上海市科技重大专项以及中科院特别研究助理项目经费支持。 文章链接:https://www.nature.com/articles/s41467-022-28586-0#Sec17 关联文章:https://www.nature.com/articles/s41467-020-14728-9
图2. FpRs配体的保守识别和激活机制。不同FpR2配体在保守激活腔内的构象高度重合(左图),通过与保守氨基酸D3.33, R5.38 和R5.42的极性相互作用,将特定基团定位到激活腔内,进而激活受体。 FpR1和FpR2对不同的甲酰肽具有结合的偏好性,研究结果表明,FpR1上的非保守氨基酸Y2576.51和F1023.29与甲酰肽形成更多的相互作用,相比于FpR2,FpR1的近胞外端结构更为狭窄,在空间上限制了长链甲酰肽与其结合,这些因素共同决定了FpR1偏好性识别短链甲酰肽而FpR2倾向于结合长链甲酰肽。 上海药物所副研究员庄友文、美国匹兹堡大学博士后Lei Wang为该论文的共同第一作者,上海药物所为第一单位。徐华强研究员、张诚教授为共同通讯作者。参加这项研究的还有上海药物所研究生郭嘉、王悦和刘卫一,以及匹兹堡大学博士后孙大鹏,其中,郭嘉在冷冻电镜样品制备和数据处理过程中做出了重要的贡献。此项工作得到了美国国立卫生研究院、科技部重点研发计划项目、中科院先导计划、上海市科技重大专项以及中科院特别研究助理项目经费支持。 文章链接:https://www.nature.com/articles/s41467-022-28586-0#Sec17 关联文章:https://www.nature.com/articles/s41467-020-14728-9
 图1. 不同配体结合下FpR1-Gi以及FpR2-Gi信号复合物的冷冻电镜密度图和三维结构模型。 研究发现,甲酰肽fMLFII以N端朝口袋内部的方式结合到FpR1和FpR2上,与科研人员前期用计算机模拟得出的结论一致。结构比对发现,fMLFII在FpR1和FpR2中的结合模式高度相似,其N末端的甲酰基与FpR1/FpR2配体结合口袋内部保守的氨基酸残基D3.33, R5.38 和R5.42形成极性相互作用网络,这三个保守的氨基酸充当“钳子”的作用,将甲硫氨酸侧链以正确的构象定位到口袋底部由保守氨基酸W6.48 、p5.50、F6.44以及V3.40形成的狭窄的激活腔中,引起腔内氨基酸构象变化,进而激活FpRs,这表明FpR1/FpR2通过保守的模式识别甲酰肽。值得注意的是,保守激活腔内的氨基酸W6.48 、p5.50、F6.44以及V3.40是Class A 类GpCRs激活的关键基序。通过比较WKYMVm, 甲酰肽fMLFII, CGEN-885A以及Compound 43四种不同配体结合的FpR2结构发现,虽然这些配体在FpR2正性结合口袋的结合模式各异,但是三种多肽配体的C端/N端甲硫氨酸侧链以及Compound 43的氯苯基在保守激活腔中构象高度重合,并且均与保守氨基酸D3.33, R5.38 和R5.42形成极性相互作用网络,表明不同FpRs配体与甲酰肽配体共享上述相似的受体激活分子机制。
图1. 不同配体结合下FpR1-Gi以及FpR2-Gi信号复合物的冷冻电镜密度图和三维结构模型。 研究发现,甲酰肽fMLFII以N端朝口袋内部的方式结合到FpR1和FpR2上,与科研人员前期用计算机模拟得出的结论一致。结构比对发现,fMLFII在FpR1和FpR2中的结合模式高度相似,其N末端的甲酰基与FpR1/FpR2配体结合口袋内部保守的氨基酸残基D3.33, R5.38 和R5.42形成极性相互作用网络,这三个保守的氨基酸充当“钳子”的作用,将甲硫氨酸侧链以正确的构象定位到口袋底部由保守氨基酸W6.48 、p5.50、F6.44以及V3.40形成的狭窄的激活腔中,引起腔内氨基酸构象变化,进而激活FpRs,这表明FpR1/FpR2通过保守的模式识别甲酰肽。值得注意的是,保守激活腔内的氨基酸W6.48 、p5.50、F6.44以及V3.40是Class A 类GpCRs激活的关键基序。通过比较WKYMVm, 甲酰肽fMLFII, CGEN-885A以及Compound 43四种不同配体结合的FpR2结构发现,虽然这些配体在FpR2正性结合口袋的结合模式各异,但是三种多肽配体的C端/N端甲硫氨酸侧链以及Compound 43的氯苯基在保守激活腔中构象高度重合,并且均与保守氨基酸D3.33, R5.38 和R5.42形成极性相互作用网络,表明不同FpRs配体与甲酰肽配体共享上述相似的受体激活分子机制。  图2. FpRs配体的保守识别和激活机制。不同FpR2配体在保守激活腔内的构象高度重合(左图),通过与保守氨基酸D3.33, R5.38 和R5.42的极性相互作用,将特定基团定位到激活腔内,进而激活受体。 FpR1和FpR2对不同的甲酰肽具有结合的偏好性,研究结果表明,FpR1上的非保守氨基酸Y2576.51和F1023.29与甲酰肽形成更多的相互作用,相比于FpR2,FpR1的近胞外端结构更为狭窄,在空间上限制了长链甲酰肽与其结合,这些因素共同决定了FpR1偏好性识别短链甲酰肽而FpR2倾向于结合长链甲酰肽。 上海药物所副研究员庄友文、美国匹兹堡大学博士后Lei Wang为该论文的共同第一作者,上海药物所为第一单位。徐华强研究员、张诚教授为共同通讯作者。参加这项研究的还有上海药物所研究生郭嘉、王悦和刘卫一,以及匹兹堡大学博士后孙大鹏,其中,郭嘉在冷冻电镜样品制备和数据处理过程中做出了重要的贡献。此项工作得到了美国国立卫生研究院、科技部重点研发计划项目、中科院先导计划、上海市科技重大专项以及中科院特别研究助理项目经费支持。 文章链接:https://www.nature.com/articles/s41467-022-28586-0#Sec17 关联文章:https://www.nature.com/articles/s41467-020-14728-9
图2. FpRs配体的保守识别和激活机制。不同FpR2配体在保守激活腔内的构象高度重合(左图),通过与保守氨基酸D3.33, R5.38 和R5.42的极性相互作用,将特定基团定位到激活腔内,进而激活受体。 FpR1和FpR2对不同的甲酰肽具有结合的偏好性,研究结果表明,FpR1上的非保守氨基酸Y2576.51和F1023.29与甲酰肽形成更多的相互作用,相比于FpR2,FpR1的近胞外端结构更为狭窄,在空间上限制了长链甲酰肽与其结合,这些因素共同决定了FpR1偏好性识别短链甲酰肽而FpR2倾向于结合长链甲酰肽。 上海药物所副研究员庄友文、美国匹兹堡大学博士后Lei Wang为该论文的共同第一作者,上海药物所为第一单位。徐华强研究员、张诚教授为共同通讯作者。参加这项研究的还有上海药物所研究生郭嘉、王悦和刘卫一,以及匹兹堡大学博士后孙大鹏,其中,郭嘉在冷冻电镜样品制备和数据处理过程中做出了重要的贡献。此项工作得到了美国国立卫生研究院、科技部重点研发计划项目、中科院先导计划、上海市科技重大专项以及中科院特别研究助理项目经费支持。 文章链接:https://www.nature.com/articles/s41467-022-28586-0#Sec17 关联文章:https://www.nature.com/articles/s41467-020-14728-9 





























