Cell Reports揭示天然免疫信号调控m6A修饰的新机制
2022年2月15日,来自北京大学基础医学院游富平团队在Cell Reports发表了题为“TBK1-METTL3 axis facilitates antiviral immunity”的研究论文,报道了天然免疫信号通路上的关键激酶TBK1可在病毒感染后与METTL3直接相互作用,并通过对METTL3功能的双重调控增强机体一型干扰素应答。
真核生物mRNA上通常携带多种化学修饰,其中N6-甲基腺苷(m6A)是最常见的一种mRNA内部修饰。m6A修饰影响了mRNA的出核、稳定、剪接和翻译等,从而参与调控各种生物学进程。在病毒感染过程中,m6A通过调控多种抗病毒因子的mRNA代谢,影响宿主抗病毒免疫应答。然而,目前研究大多关注m6A对抗病毒天然免疫的影响,少有研究报道天然免疫信号对m6A及其催化复合体的调控。已有研究表明,病毒感染可以上调METTL3和METTL14的蛋白水平及其介导的m6A甲基化修饰。最近研究指出,病毒感染改变了宿主的m6A表观转录组,且该过程依赖于天然免疫的活化,但具体调控机制有待进一步研究。此外,除了催化m6A反应,METTL3还可以促进蛋白质翻译,且该过程并不依赖于其m6A活性,而目前对于这两种功能的调控尚无报道。
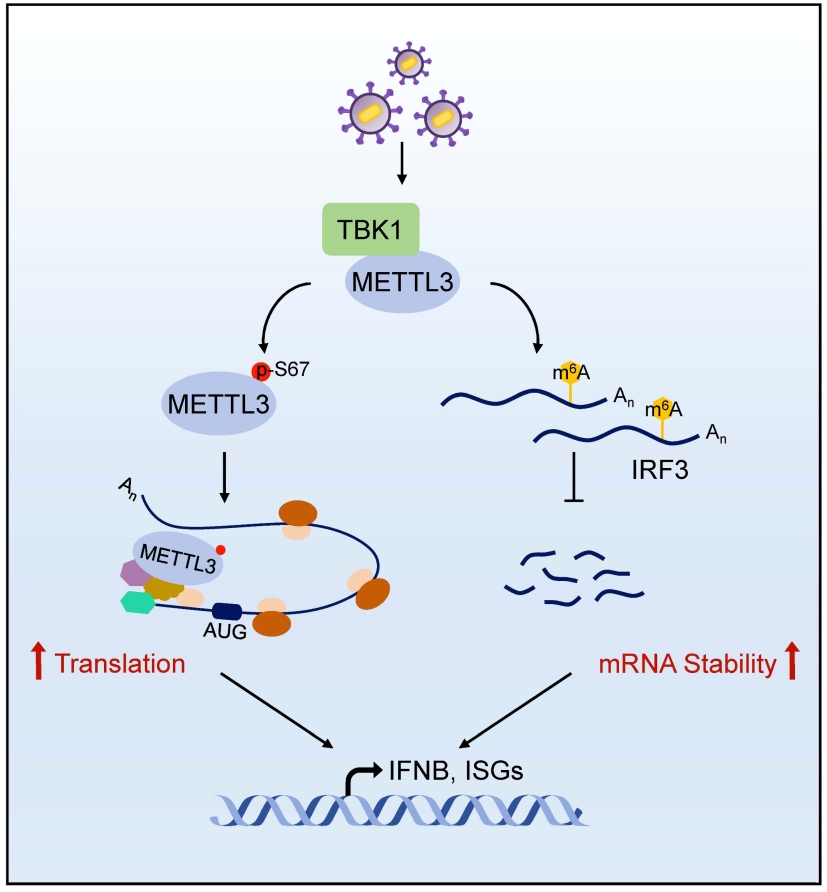
TBK1-METTL3 轴调节抗病毒天然免疫
在这项研究中,作者首先通过蛋白质谱分析,结合免疫共沉淀和微量热泳动实验,证实了METTL3与TBK1存在直接相互作用,且METTL3可以协同TBK1激活IFNβ表达。之后通过体外激酶反应和磷酸化修饰质谱,证实TBK1可以磷酸化METTL3第67位丝氨酸。将该位点突变后,METTL3协同TBK1激活IFNβ表达的能力明显减弱。同样地,将METTL3的催化活性位点突变后(D395A),其对TBK1的协同能力也明显减弱。于是,作者猜测该磷酸化位点是否影响了METTL3的m6A活性。m6A定量实验表明,病毒感染可以诱导胞内m6A水平上调,而在Tbk1敲除细胞中,病毒诱导的m6A水平明显降低,提示病毒感染后TBK1可以促进METTL3催化活性。同样,体外RNA甲基化实验也证实了,TBK1可以显著增强METTL3/METTL14复合体介导的m6A反应。然而,该过程并不依赖于METTL3 S67磷酸化和TBK1激酶活性。接着,通过m6A甲基化测序,作者找到了TBK-METTL3下游的一个效应分子——IRF3。病毒感染后,TBK1可以促进METTL3在IRF3 mRNA终止密码子附近的m6A甲基化,从而稳定IRF3 mRNA,然而该过程也不依赖于METTL3的S67磷酸化。
为了继续探究S67磷酸化对METTL3功能的影响,作者分析了野生型和S67A突变METTL3的蛋白质谱。结果发现,TBK1可以促进METTL3与翻译相关蛋白之间的相互作用,而将S67位点突变后,这类互作蛋白消失。同样地,病毒感染可以诱导内源METTL3与翻译相关蛋白相互作用,而将Tbk1敲除细胞后,互作消失。SUnSET(surface sensing of translation)和Tethering实验结果显示,过表达野生型METTL3而非S67A突变体可以促进蛋白质翻译。相反,在Mettl3敲除细胞中,病毒感染后蛋白合成明显减少。这些结果表明,TBK1通过磷酸化METTL3第67丝氨酸,促进METTL3介导的蛋白质翻译,而该过程可能也参与调控一型干扰素应答。
综上,该研究揭示了天然免疫信号调控m6A修饰的新机制,即TBK1同时参与调控METTL3的m6A活性和蛋白质翻译功能,促进机体的一型干扰素应答。
北京大学基础医学院的游富平教授为该论文的通讯作者。北京大学2016级博士生陈靖轩、2014级基础八年制韦雪梅和2018级博士生王晓为共同第一作者。
该项目获得了国家重点研发计划、国家自然科学基金重点项目、北京市自然科学基金重点研究专题的支持。
原文链接:https://doi.org/10.1016/j.celrep.2022.110373
(北京大学基础医学院)






























