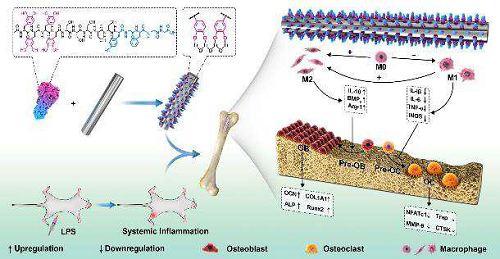
苏州大学团队开发出新的仿生肽涂层可促进骨再生
慢性炎症患者在骨内植入假体后常常会出现骨整合不良,这主要是由于促炎细胞因子的增加,诱导骨吸收并影响骨形成。为此,苏州大学附属第一医院耿德春领导的研究团队近日开发出一种仿生肽涂层植入物,可促进慢性炎症患者的骨再生。
这篇题为“Biomimetic osteogenic peptide with mussel adhesion and osteoimmuno-modulatory functions to ameliorate interfacial osseointegration under chronic inflammation”的论文发表在《Biomaterials》杂志上。
严重的骨关节炎和病理性骨折在治疗时通常需要使用植入物,这就要求植入物表面与宿主骨组织之间进行快速有效的骨整合。在生物材料植入后,免疫系统被激活以调节宿主的局部微环境,因此,具有骨免疫调节性能的骨再生材料可以通过调节成骨细胞和破骨细胞的行为来促进骨免疫平衡。
然而,许多接受骨内植入的患者也同时患有其他疾病,比如类风湿性关节炎、糖尿病等。他们的一个共同特点是全身基础炎症水平高于一般人群。这种炎症微环境可显著增加局部巨噬细胞的积累,并阻碍成骨分化。为此,研究人员希望对植入物进行改造,以改善植入物周围的成骨性。
仿生肽的合成
在这项研究中,研究人员首先合成了一种仿生设计的肽(DOpA)4-S5-YGFGG。它将富含贻贝足蛋白(Mfps)的四价含儿茶酚(DOpA)4序列与成骨生长肽(OGp)的片段整合在一起。OGp的C端片段(YGFGG)能够在体外和体内增强成骨细胞的增殖与分化。受贻贝启发的儿茶酚肽自发并稳定地结合到钛基植入物上。
图1. 这项研究的示意图
仿生肽对骨整合的影响
之后,他们在全身慢性炎症的条件下,在体内研究仿生肽涂层对植入物骨整合的影响。他们将90只大鼠随机分成三组:假手术Sham组(无多肽涂层,未注射LpS),模型Vehicle组(无多肽涂层,注射LpS)和肽涂层peptide-coated组(注射LpS)。
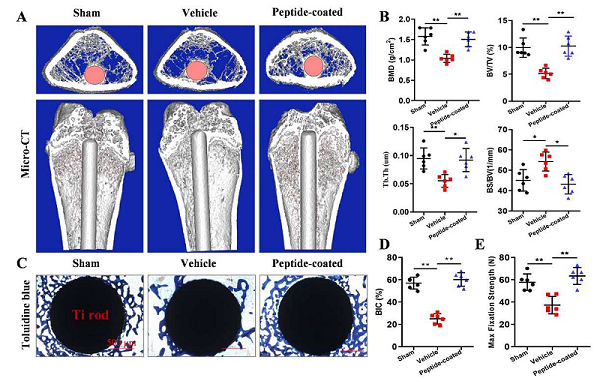
对于LpS处理的大鼠,植入物周围存在明显的骨质流失和骨量减少。当钛棒涂有(DOpA)4-S5-YGFGG肽时,骨质流失显著减轻,而植入物周围的新骨基质密度更高。与模型组相比,肽涂层组的种植体骨结合率(BIC)提高近三倍(图2)。这些数据表明,仿生肽的包被调节了骨重塑并增强了钛基植入物的骨整合。
图2. 植入物在不同条件下的骨整合。
同时,组织学分析也证实了肽涂层在慢性炎症下的骨保护作用。H&E染色的结果表明,仿生肽可减少植入物周围的骨质流失。由于骨质流失可能是由炎症条件下成骨细胞与破骨细胞之间的不平衡相互作用引起的,故研究人员分析了骨吸收和骨形成的标志物。他们发现,在与慢性炎症相关的骨质流失过程中,仿生肽可抑制骨吸收并增强骨形成。
仿生肽可调节巨噬细胞的极化
研究人员还观察到,模型组骨组织中的促炎介质上调,包括TNF-α、IL-1β和IL-6,而肽涂层组的IL-10表达水平增加,这是一种抗炎介质。考虑到主要是巨噬细胞参与了炎症反应,他们于是在体内研究了巨噬细胞的活化。
模型组可观察到大量表达M1标志物(iNOS和CD86)的促炎巨噬细胞和少量表达M2标志物(Arg-1和CD206)的抗炎巨噬细胞。然而,在肽涂层组中,M1型巨噬细胞的浸润被逆转,M2型巨噬细胞的比例增加(图3)。这些结果表明,仿生肽可以将巨噬细胞从促炎的M1表型转化为抗炎的M2表型来抑制炎症并促进骨整合。后续体外分析也证明了这一点。
图3. 植入物周围的巨噬细胞的表型分析。
仿生肽通过NF-κB通路促进成骨分化
最后,研究人员还在体外研究了仿生肽对破骨细胞和成骨细胞生成的影响。通过条件培养基的分析,他们发现当条件培养基来源于在仿生肽涂层样品上培养的巨噬细胞时,破骨细胞的形成和骨吸收减少。仿生肽降低了与破骨细胞生成相关的多个基因的表达水平,包括NFATc1、MMp-9、CTSK、Trap和OSCAR。
通过对小鼠MC3T3-E1细胞的分析,他们也证明仿生肽逆转了LpS对成骨的抑制作用。在暴露于LpS后,成骨细胞标志物的基因表达下降,而在暴露于仿生肽后,LpS的抗成骨作用受到抑制。后续的通路分析表明,仿生肽通过BMp2-Smads和NF-κB通路来促进成骨细胞分化。研究中所用的成骨诱导分化培养基由赛业生物提供。
结语
总的来说,研究人员合成了一种仿生设计的肽段,能够在炎症条件下调节界面的破骨细胞和成骨细胞。肽涂层植入物可减轻炎症,并调节巨噬细胞的极化,将其从促炎M1表型转化为抗炎M2表型,从而抑制骨吸收,并增强骨形成和骨整合。这项成果为骨再生生物材料的表面改造铺平了道路。
原文检索
Bai J, Wang H, Chen H, Ge G, Wang M, Gao A, Tong L, Xu Y, Yang H, pan G, Chu pK, Geng D, Biomimetic osteogenic peptide with mussel adhesion and osteoimmunomodulatory functions to ameliorate interfacial osseointegration under chronic inflammation, Biomaterials (2020), doi: https://doi.org/10.1016/j.biomaterials.2020.120197.