药学院霍帅东团队以Hot Paper形式在Angew. Chem. 合作发表超声调控生物酶催化活性的研究进展
近日,厦大药学院霍帅东教授与德国莱布尼兹材料研究所Andreas Herrmann教授团队合作,在利用超声机械力调控生物酶催化活性领域取得了新进展。相关研究成果以“Activation of the Catalytic Activity of Thrombin for Fibrin Formation by Ultrasound”为题发表在Angewandte Chemie(《德国应用化学》),该文同时被遴选为Hot paper。该研究是基于此前提出的超声机械力活化药物的新概念(Nature Chemistry 2021,13,131–139)以及利用超声机械力调控蛋白质结构与性质(Angew. Chem. Int. Ed. 2021,60,1493–1497)的进一步深入探索。
蛋白质是生物体的物质基础,其中的酶几乎参与所有生物反应,酶催化过程的失调与许多疾病的发生密切相关。因此,实现对酶活性的精确调控不仅有利于理解复杂的生物反应过程,更有助于进一步开发新的治疗策略。在这项工作中,研究人员首先利用合成的多聚适配体与凝血酶特异性结合,抑制其催化活性。随后分别使用实验超声(20 kHz)和医用聚焦超声(5 MHz)对多聚适体-凝血酶之间的相互作用进行了选择性破坏,从而恢复了凝血酶活性,催化了纤维蛋白原向纤维蛋白的转化。进一步地,研究人员将其扩展到纳米颗粒-适配体系统。凝血酶的存在将特异性诱导两种金纳米颗粒的聚集组装(表面分别修饰凝血酶裂分适配体),同时使酶失活。超声机械力的施加可以特异性分散颗粒聚集体,同时激活凝血酶的催化活性,重要的是,该体系的超声响应过程完全可逆,可以实现对凝血酶催化活性“抑制-激活”的多次循环。
该项研究通过超声机械力选择性调控了适配体与生物酶的相互作用,同时验证了医用聚焦超声对该系统的适用性,为实现对体内蛋白质功能的远程调控提供了新策略。德国莱布尼兹材料研究所的赵鹏坤博士为该研究论文的第一作者,霍帅东教授与Andreas Herrmann教授为共同通讯作者。
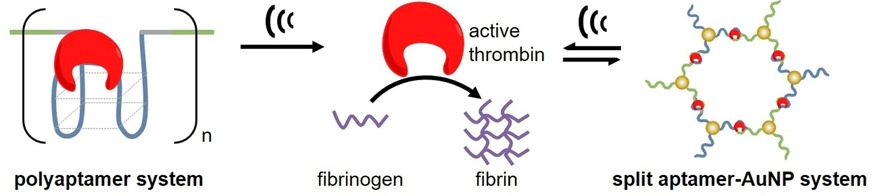
超声机械力选择性调控凝血酶催化活性的示意图
文章链接:
(英语版)https://onlinelibrary.wiley.com/doi/10.1002/anie.202105404
(德语版)https://onlinelibrary.wiley.com/doi/10.1002/ange.202105404






























