我院夏宁邵教授团队提出一种新型嵌合多肽生物大分子入胞递送系统
疾病的发生发展通常与细胞内信号网络异常相关,利用药物靶向调节相应的关键分子或功能途径进行干预是基础研究和临床治疗的重要手段。传统小分子药物的作用靶标必须具备特殊的“疏水口袋”,导致仅有部分(20%)靶标蛋白可用于小分子药物的研究,相比之下生物大分子药物(如蛋白质、抗体、核酸等)在识别的靶分子类型上几乎没有限制,并且在靶向特异性及药效上也独具优势,这使其成为药物研发最具前景而又竞争激烈的领域之一。目前的生物大分子药物主要是针对胞外或膜上靶标,然而,70%的药物潜在靶标是位于细胞内部的,细胞膜的选择通透性导致生物大分子难以企及这个巨大的药物宝库。因此,如何有效地将生物大分子递送到细胞内部成为生物大分子治疗以及基础生物学研究的当务之急。细胞穿膜肽(Cell penetrating peptides, Cpps),可介导生物大分子入胞,并且具有生物相容性高、操作简便、毒副作用低等优势,是目前生物大分子递送领域的研究热点之一。但是,Cpps仍面临着递送效率低以及体内应用时血清耐受性差等问题,这也导致在开展Cpps研究后的三十多年间,还未有基于Cpps的临床药物获批上市。我院夏宁邵团队提出了一种新型的嵌合多肽生物大分子入胞递送系统,克服了上述Cpps在应用中的瓶颈,并将其成功用于小鼠急性肝损伤体内治疗模型中。
该研究团队首先着力于解决Cpps递送效率低的问题,尤其是内吞小泡逃逸效率低的问题(90-99%的Cpps无法从内吞小泡中逃逸,导致其最终在溶酶体中降解(图.1a))。此前,有研究显示pH敏感肽的酸化变构可破坏内吞小泡囊膜,因此常被用于提升Cpps的内吞小泡逃逸效率,但由于Cpps、pH敏感肽与囊膜之间较强的粘附作用,被转运的蛋白货物分子大部分仍无法从内吞小泡中成功逃逸(图.1b)。该团队从研究最为深入的细胞穿膜肽TAT入手,在TAT+pH敏感肽(INF7)基础上,创新性地引入内吞小泡特异性蛋白酶酶切位点,利用内吞小泡内蛋白酶的酶切作用,促使货物分子与递送系统分离,从而有效地提高了内吞小泡逃逸效率(例如以GFp为货物分子时,内吞小泡逃逸效率可提高4~5倍)(图.1c)。另一方面,血清耐受性差严重影响着Cpps系统的体内应用。研究人员发现血清中大量的带有负电性的蛋白(如白蛋白)会与带有正电荷的Cpps结合,从而影响Cpps与细胞膜接触,最终抑制Cpps的递送。该研究团队引入多聚化结构域(如亮氨酸拉链,Leu-zipper)形成多价Cpps系统,克服了血清中的主要成分白蛋白对递送过程的影响,在一定程度上解决了血清耐受性差的问题(图.1e)。最终,将上述两种策略联用构建的嵌合肽eTAT(enhanced TAT)递送系统,同时拥有高效的递送效率(例如eTAT介导的GFp入胞效率相较于TAT介导提高了12倍)以及良好的血清耐受程度,展现出其在体内的应用潜力(图.1d)。
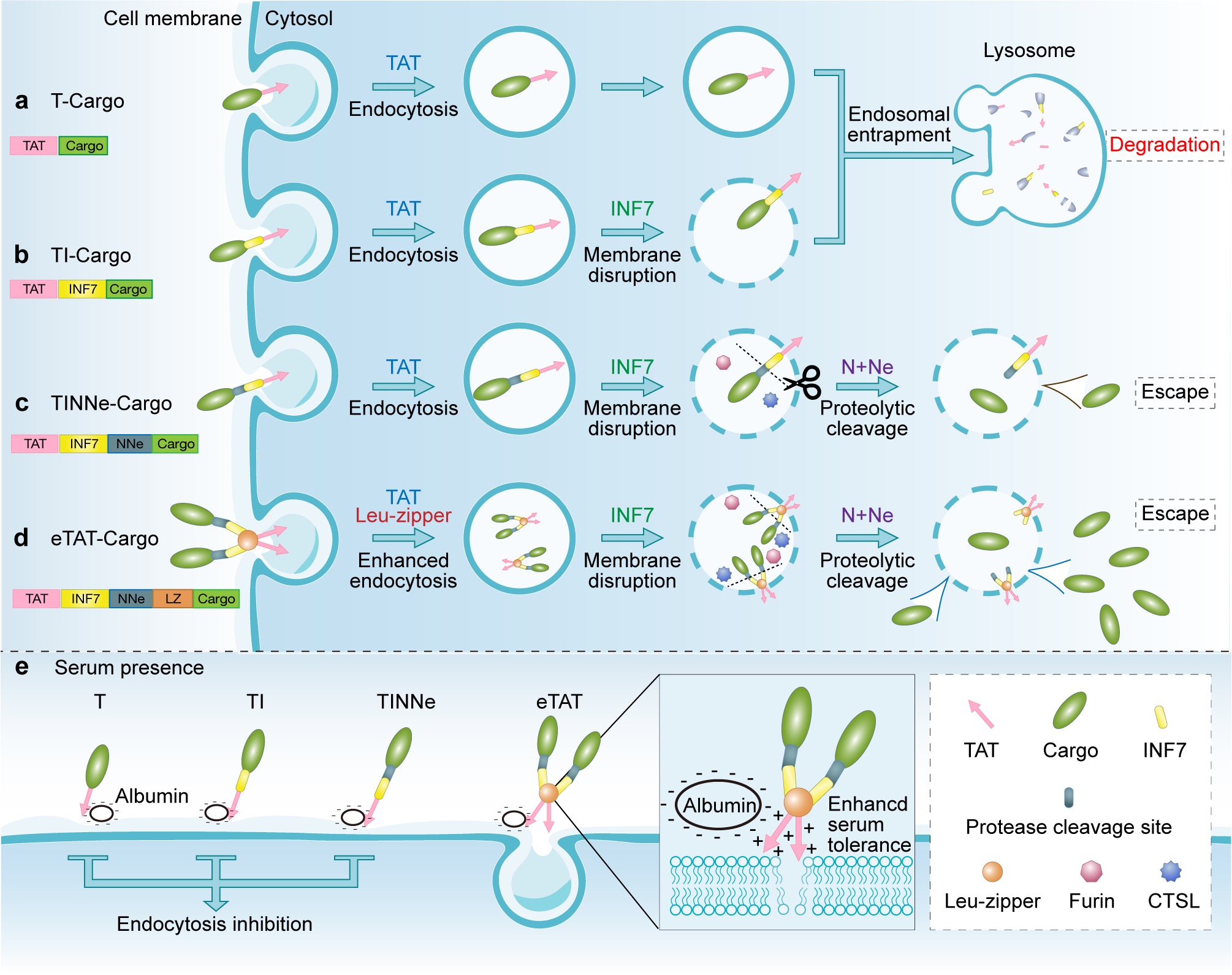
图1. eTAT与其它基于TAT 的递送系统的比较
随后,该研究团队以细胞内介导细胞坏死途径的RIp3蛋白为药物靶标,将eTAT系统与功能性蛋白ppm1b融合表达组成治疗性分子eTAT-ppm1b,用于小鼠急性肝损伤的治疗。ApAp(对乙酰氨基酚,泰诺?)是目前世界范围内最常用的解热镇痛药物,但其过量使用会通过RIp3介导的坏死性凋亡途径引起急性肝脏损伤甚至死亡。此前,有研究显示ppm1b可使位于胞内靶标RIp3去磷酸化从而阻断坏死性凋亡途径。该研究团队将eTAT-ppm1b重组蛋白尾静脉注射小鼠,结果显示eTAT-ppm1b将ApAp导致的小鼠死亡率从100%降至40%,效果显著优于目前FDA批准的唯一一款针对该疾病的药物NAC(死亡率80%)。
eTAT作为一种通用型的递送系统,只需与不同的功能蛋白质结合,即可实现相应胞内靶标的干预及功能调节,达到治疗相关疾病的目的。例如,eTAT系统与核酸结合蛋白融合,可介导mRNA、DNA形式的生物大分子入胞并表达,从而补充功能丧失或在生理水平上表达缺陷的基因或者诱导机体产生相应的免疫应答,同时也可介导小干扰RNA(siRNA)入胞实现疾病相关基因表达的下调;eTAT与基因编辑工程酶(如CRISpR/Cas9)结合,实现对疾病相关基因的操纵以达到治疗效果。总之,该研究不仅为生物大分子的胞内递送提供新的策略,而且为针对胞内靶标的蛋白药物的基础研究和临床应用奠定基础。
近日,相关研究成果以题为“Efficient intracellular delivery of proteins by a multifunctionalchimaeric peptide in vitro and in vivo”的论文在线发表于《自然?通讯》(Nature Communications)。我院博士生于思远、博士生杨晗、高级工程师李廷栋、博士生潘海峰为该论文的共同第一作者。我院夏宁邵教授、葛胜祥教授、袁权教授为该论文的共同通讯作者。该研究获得科技部国家重点研发计划、福建省自然科学基金重点项目、国家自然科学基金的资助。
论文链接:https://www.nature.com/articles/s41467-021-25448-z
(国家工程中心)






























