赵同金教授团队揭示DDB1在调控脂肪组织发育和肥胖发生中的生理作用
脂肪细胞分化(Adipogenesis)是脂肪前体细胞转变为成熟脂肪细胞的过程,与肥胖病等代谢性疾病的发生密切相关。该过程是由一系列的转录因子高度协同完成的,由多重转录事件构成【1】。目前,脂肪细胞分化中的关键转录因子相继被鉴定出来【2-4】,但是脂肪前体细胞是如何整合外界信号并开启转录事件的,目前知之甚少。
DDB1 (Damage-specific DNA binding protein 1) 是一种多功能蛋白,最早是作为紫外诱导复合物(与DDB2形成异源二聚体)中的一个组分被发现的。目前,DDB1被广泛认为是Cullin 4(CUL4)泛素连接酶复合物的重要架构蛋白, 通过含有WD40结构域的蛋白作为适配器来识别并泛素化底物蛋白,从而调控一系列的生理过程【5-6】。最近的研究发现,抗肥胖因子WDTC1【7】能够通过CUL4来抑制脂肪细胞的分化【8】,但是CUL4-DDB1-WDTC1的底物蛋白并不清楚。
2021年6月22日,复旦大学代谢与整合生物学研究院赵同金课题组在Cell Reports杂志上发表了题为DDB1 Binds Histone Reader BRWD3 to Activate the Transcriptional Cascade in Adipogenesis and promote Onset of Obesity的研究论文,发现了脂肪细胞分化中DDB1能够以不依赖CUL4的方式开启转录事件的分子机制,揭示了DDB1在调控脂肪组织发育和肥胖发生中的生理作用。
作者研究发现DDB1能以不依赖于CUL4的形式促进脂肪细胞分化,而且DDB1对于脂肪细胞分化最早期基因的表达是必需的。进一步通过RNA-Seq和ChIp-Seq等手段,作者发现DDB1是通过调控RNA聚合酶II暂停释放(pol II pausing release)来开启脂肪细胞分化的转录起始事件。pol II pausing release调控很多发育或应激相关的即时响应基因的转录【9】,但在脂肪细胞分化中的作用不清楚。该研究发现,在没有分化刺激时,DDB1能够通过乙酰化组蛋白阅读子BRWD3结合到最早期基因启动子上。此时,转录起始复合物已经组装完成,pol II转录20-60个核酸后处于暂停状态;当收到分化信号刺激时,正向转录延伸因子b(p-TEFb)从其抑制复合物中解离释放,被DDB1招募到最早期基因启动子区域,活化并释放暂停的pol II,从而开启了脂肪细胞分化的第一级转录事件(图1)。
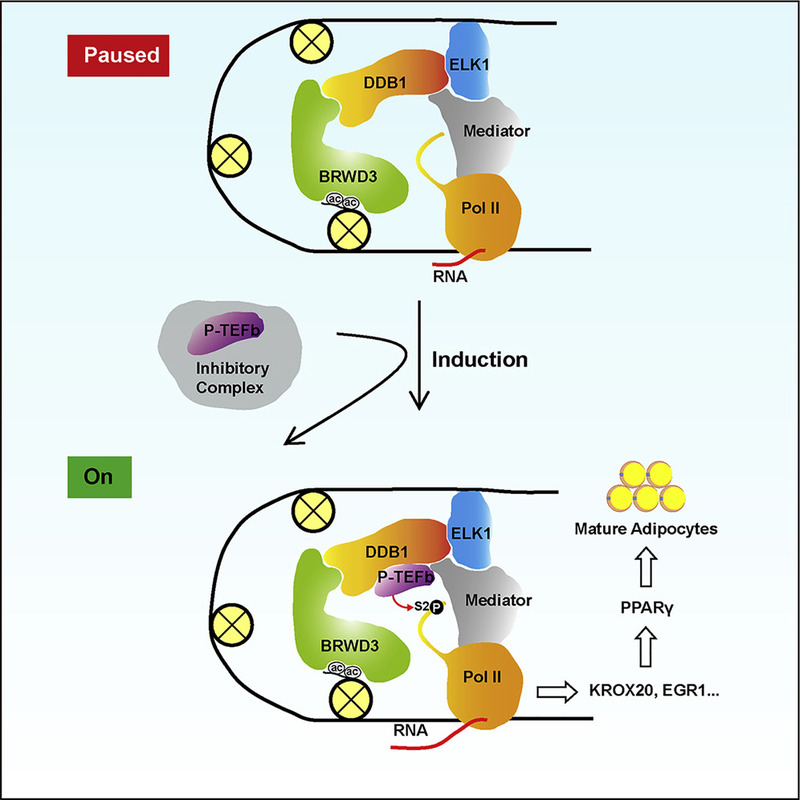
图1:DDB1调控脂肪细胞分化转录起始的机制
该研究揭示了DDB1能够以不依赖于CUL4的方式促进脂肪细胞分化过程中转录事件起始的分子机制,并发现了pol II pausing release在调控脂肪细胞分化中的生理作用。
复旦大学代谢与整合生物学研究院博士后王旭,厦门大学生命科学学院博士生王皓燕、药学院博士生胡国升为该论文的共同第一作者,复旦大学代谢与整合生物学研究院赵同金教授为本论文的通讯作者。同时,该研究获得了包括复旦大学/清华大学李蓬院士课题组,厦门大学王洪睿课题组、陈颖课题组和刘文课题组,以及上海交通大学黄晶课题组的大力支持。
论文链接:https://doi.org/10.1016/j.celrep.2021.109281
参考文献
Rosen ED, Spiegelman BM. What we talk about when we talk about fat. Cell, 2014, 156(1-2):20-44.
Siersbaek R, Nielsen R, Mandrup S. Transcriptional networks and chromatin remodeling controlling adipogenesis. Trends Endocrinol Metab, 2012, 23(2):56-64.
Lefterova MI, Lazar MA. New developments in adipogenesis. Trends Endocrinol Metab, 2009, 20(3):107-114.
Wang W, Huang L, Huang Y, et al. Mediator MED23 links insulin signaling to the adipogenesis transcription cascade. Dev Cell, 2009, 16(5):764-771.
Jin J, Arias EE, Chen J, et al. A family of diverse Cul4-Ddb1-interacting proteins includes Cdt2, which is required for S phase destruction of the replication factor Cdt1. Mol Cell, 2006,23(5):709-721.
Angers S, Li T, Yi X, et al. Molecular architecture and assembly of the DDB1-CUL4A ubiquitin ligase machinery. Nature, 2006, 443(7111):590-593.
Suh JM, Zeve D, McKay R, et al. Adipose is a conserved dosage-sensitive antiobesity gene. Cell metabolism, 2007, 6(3):195-207.
Groh BS, Yan F, Smith MD, et al. The antiobesity factor WDTC1 suppresses adipogenesis via the CRL4WDTC1 E3 ligase. EMBO Rep, 2016, 17(5):638-647.
Levine, M. paused RNA polymerase II as a developmental checkpoint. Cell, 2011, 145(4):502-511.






























