生命学院李蓬实验室揭示凝胶样二维相分离介导脂滴相互作用、脂滴融合以及脂稳态调控
脂滴是细胞内储存中性脂质的细胞器,在脂稳态调控和疾病发生中扮演着重要的角色,脂滴的生成、融合和生长缺陷可导致代谢性疾病如肥胖、脂肪肝、糖尿病和动脉粥样硬化等的发生发展。CIDE家族蛋白(包含Cidea,Cideb与Cidec/Fsp27)是一类脂滴结合蛋白,主要富集于脂滴-脂滴接触位点(lipid droplet contact site,LDCS),介导中性脂从小脂滴(供体)向大脂滴(受体)的转移,从而实现脂滴融合和增大,促进中性脂在细胞内的储存,是脂稳态的重要调节者。然而,CIDE蛋白在LDCS上富集的生物化学机制,LDCS处的内部结构以及其介导脂质流通和脂滴融合的机制仍不清楚。
2021年9月10日,清华大学李蓬团队在Developmental Cell杂志上在线发表了题为“Cidec通过凝胶样相分离产生脂质可透过盘状结构促进脂滴融合”(A gel-like condensation of Cidec generates lipid-permeable plates for lipid droplet fusion)的研究论文,作者通过生物化学、细胞生物学、超分辨影像系统以及生物物理学建模手段,发现调节脂滴融合的重要蛋白Cidec可通过凝胶样的特殊相分离方式富集于LDCS,组装并形成高度可塑的、可允许脂质在脂滴间交换和转移的脂滴融合盘结构,从而促进中性脂从小脂滴向大脂滴转移,最终实现脂滴融合生长以及高效的脂质储存。该研究首先提出并证明了相分离在细胞器互作和脂稳态调控中的作用。
近十年来许多研究表明:相分离引起的在特定亚细胞器上的蛋白富集是促进时空调控特定复杂生物学功能的必要因素。作者首先运用成像技术手段发现Cidec在LDCS上富集主要由Cidec的N端同型多价互作介导,接着作者纯化了Cidec-N蛋白,与其他可进行液-液相变的蛋白不同,Cidec-N在体外可进行凝胶样(gel-like)相分离(图1),细胞内影像实验也进一步证明了Cidec-N介导的凝胶样特性,同时证明了Cidec-N介导的凝胶样相分离是Cidec介导脂滴融合和生长的必要条件(图1)、作者继续使用多种成像技术以及生物物理建模方法,发现Cidec在脂滴结合处通过二维相分离会组装形成高度可塑的且脂质可交换和转移的脂滴融合盘结构:他们还发现当供体脂滴在融合过程中逐渐缩小时,脂滴融合盘的宽度(w)与脂质可渗透面积(A)受供体脂滴大小的限制,而厚度(s)维持不变(图2)。作者进一步通过电子断层扫描成像与超分辨荧光成像鉴定了接触位点的内部结构是随机分布的多个孔隙,并且成像测得的孔隙大小和脂质转运能力相匹配。最后,该研究还发现供体脂滴可能通过曲率的变化,降低相分离的效率(reverse phase separation)限制CIDE蛋白在脂滴结合处的富集,减小了脂滴融合盘的结构,降低了脂质转移的速度和脂滴融合的效率,揭示CIDE蛋白的相分离与反向相分离的协同作用可以有效控制脂滴融合过程中中性脂的转移与脂滴的稳定性(图2)。
综上,这项研究揭示了膜限制的Cidec二维相分离是脂滴相互作用和脂滴融合盘结构形成以及脂滴融合的基础,同时指出这类膜结合的二维性相分离可能也介导细胞器互作、膜融合、细胞器内含物的交换或分子转运等重要细胞生物学过程。这让我们再次见识到蛋白相分离所展现的广泛生物学功能。
清华大学生命科学学院吕旭超博士、王佳博士、和博士生王剑琴同学为该论文的共同第一作者,李蓬教授和复旦大学代谢与整合生物学研究院陈丰荣青年研究员为共同通讯作者。新加坡国立大学Thorsten Wohland教授,中国科学院力学所龙勉教授,清华大学李丕龙副教授,北京大学王世强教授、孙育杰教授和陈晓伟研究员对该研究提供了重要的技术支撑。
本项研究得到膜生物学国家重点实验室,清华-北大生命科学联合中心,清华大学设施蛋白质冷冻电镜平台的支持,以及国家重点研发计划和国家自然科学基金委的资助。
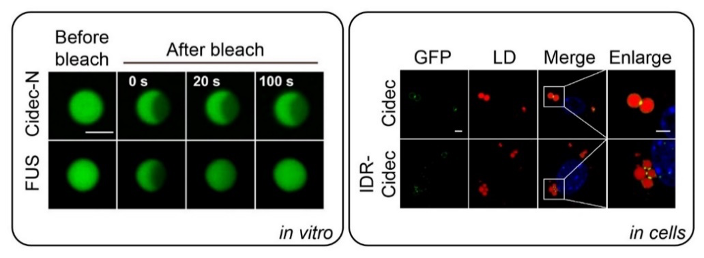
图1. 体外纯化Cidec-N-GFp和FUS-GFp液滴的荧光漂白恢复影像图;Cidec-GFp和hnRNpDL(IDR)-Cidec-GFp蛋白(绿色)在细胞内介导脂滴(红色)融合与成长的荧光图像。

图2. 脂滴融合圆盘的示意图及其形状特点;模型展示Cidec相分离与反向相分离介导脂质可渗透圆盘的组装与拆解
原文链接:https://doi.org/10.1016/j.devcel.2021.08.015






























