利用外泌体治疗骨质疏松,海军军医大学团队取得新进展
骨质疏松是老年人中常见的慢性疾病。据统计,目前全球超过2亿人罹患骨质疏松症,每3秒就有一例骨质疏松性骨折发生。我国50岁以上人群的骨质疏松症发病率为19.2%。为此,科学家们在寻找方案来逆转骨质流失。
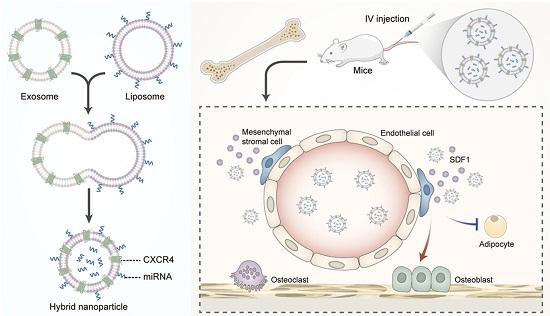
近日,海军军医大学的苏佳灿/陈晓研究团队在《Bioactive Materials》杂志上发表研究成果。他们提出了一种通过表面展示CXCR4来获得骨靶向外泌体的新方法,有望逆转与年龄相关的骨质流失。
研究背景
骨髓间充质干细胞(BMSC)是骨髓脂肪细胞和成骨细胞的祖细胞。BMSC从成骨分化转变为成脂分化,骨形成受损,是许多病理性骨质流失的特征。抑制成脂分化并促进成骨分化,有望治疗骨质疏松症。
之前的研究发现,随着年龄的增长,miR-188显著增加。这种miRNA可调节BMSC的分化命运,促进脂肪生成并抑制骨生成。因此,以miR-188为靶点进行治疗可以促进骨形成。然而,大剂量siRNA的全身给药可能对非骨骼组织产生不利影响。这就突出了骨靶向递送系统的必要性。
外泌体(exosomes)在药物递送方面展示出惊人的潜力。同时,考虑到SDF-1/CXCR4轴在造血干细胞归巢中发挥重要作用,研究人员假设CXCR4阳性的外泌体可以被招募到骨髓。于是,他们尝试用CXCR4+外泌体来实现miRNA拮抗剂的骨靶向递送,以此来逆转与年龄相关的骨质流失。
CXCR4+外泌体的体内分布
为了验证这一假设,研究人员通过慢病毒包装系统将CXCR4基因引入NIH-3T3细胞系,并通过RT-qpCR和免疫荧光证明了CXCR4在NIH-3T3细胞上成功表达。之后,他们从培养上清液中分离出外泌体,并证实CXCR4在外泌体的表面表达。
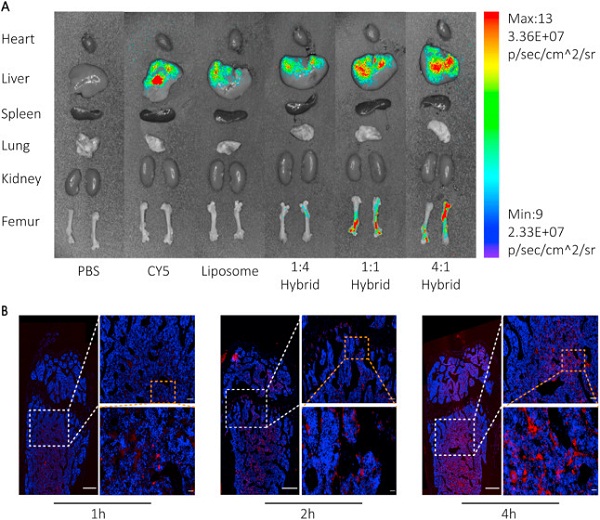
接下来,为了验证CXCR4+外泌体具有骨靶向特性,他们开展了体内追踪实验。他们用Cy5荧光染料对NIH-3T3细胞和CXCR4+ NIH-3T3细胞的外泌体进行标记,并通过尾静脉注射到小鼠体内。他们发现,CXCR4+ EXO组小鼠的股骨处存在特异性的染料富集,表明CXCR4+外泌体特异性靶向骨髓(图1)。据悉,这是第一项通过表面展示CXCR4产生骨靶向外泌体的研究。
图1. CXCR4+外泌体的体内分布
杂合纳米颗粒的骨靶向特性
之后,研究人员将CXCR4+外泌体与携带antagomir-188(miR-188拮抗剂,Cy5标记)的脂质体融合,形成杂合纳米颗粒(hybrid Np),并注射到小鼠体内。正如追踪研究所示,外泌体/脂质体比例为1:1和4:1的杂合纳米颗粒可聚集在骨髓中。此外,小鼠股骨中的荧光强度逐渐增加,这表明荧光标记的货物被捕获在骨髓中(图2)。注射48小时后,小鼠的肝肾功能保持稳定,证明纳米颗粒在体内没有细胞毒性。这些结果表明,具有骨靶向特性的CXCR4+杂合纳米颗粒被成功构建。
图2. CXCR4+杂合纳米颗粒的体内分布
杂合纳米颗粒促进成骨分化并抑制成脂分化
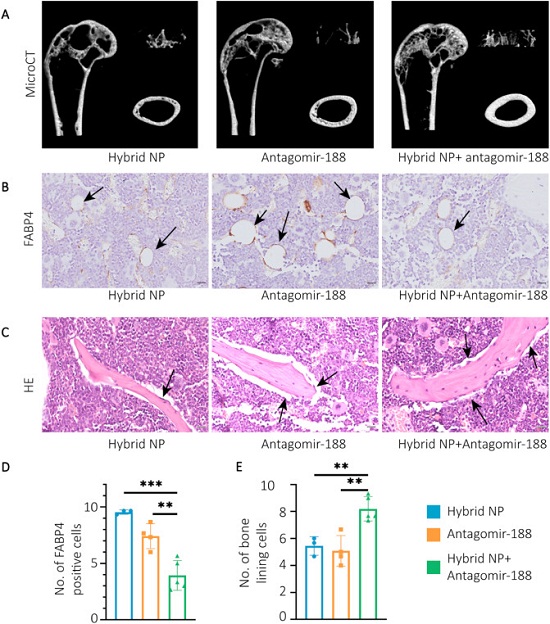
为了进一步研究携带antagomir-188的杂合纳米颗粒的功效,研究人员在年龄相关性骨质疏松症小鼠模型上测试了它的效果。他们每周一次向18月龄的老年雄性小鼠静脉内注射杂合纳米颗粒,总共持续8周。与对照相比,经antagomir-188 Np处理的小鼠显示出明显更高的骨量保留。
接下来,他们通过苏木精/伊红(H&E)染色以及脂肪酸结合蛋白4(FABp4)的免疫组化来探索骨生成和脂肪生成。他们发现,携带antagomir-188的杂合纳米颗粒降低了骨小梁周围的骨髓脂肪细胞的数量,并增加了骨衬细胞的数量(图3)。
在体外研究中,他们也发现携带antagomir-188的杂合纳米颗粒可以增加ALp阳性的成骨细胞合成。油红O染色也证明,在成脂诱导后,antagomir-188 Np抑制了BMSC中的脂质滴形成。在此,研究人员使用了赛业生物的成骨诱导分化培养基和成脂诱导分化培养基。这些结果表明,递送antagomir-188的骨靶向纳米治疗剂通过促进BMSC的成骨分化和抑制成脂分化而逆转与年龄相关的骨质流失。
图3. 杂合纳米颗粒逆转了与年龄相关的骨质流失
结语
这项研究在外泌体的表面展示了CXCR4,并将其与携带antagomir-188的脂质体融合。CXCR4+外泌体-脂质体杂合纳米颗粒倾向于在骨髓中聚集并释放antagomir-188,后者可促进成骨分化并抑制成脂分化,从而逆转与年龄相关的骨质流失。它提供了一种基于外泌体的骨靶向RNAi递送策略,有望作为病理性骨质流失的疗法。
原文检索
Exosome-guided bone targeted delivery of Antagomir-188 as an anabolic therapy for bone loss
Bioactive Materials
Volume 6, Issue 9, September 2021, pages 2905-2913