我国学者在克罗恩病免疫研究领域取得进展
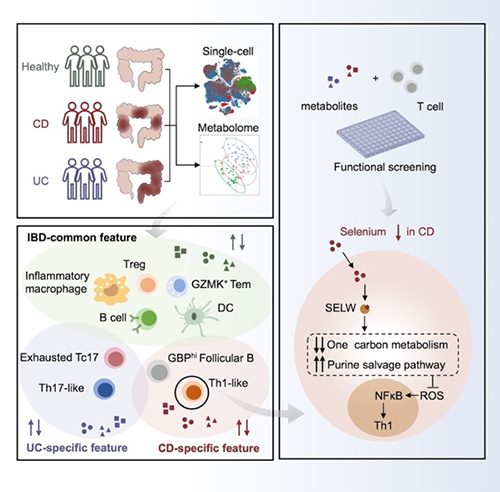
图1 炎症性肠病的免疫-代谢模式及调控机制
在国家自然科学基金项目(批准号:31822017和81970484)等资助下,浙江大学生命科学研究院靳津教授课题组和浙江大学医学院附属邵逸夫医院曹倩教授课题组合作,在炎症性肠病发病机制研究方面取得进展,研究成果以“多组学研究揭示硒元素在调控克罗恩病T细胞分化中的关键作用(Multiomic analyses reveal a critical role of selenium in controlling T cell differentiation in Crohn’s disease)”为题,于2021年8月2日在线发表在《免疫》(Immunity)杂志上。论文链接:https://doi.org/10.1016/j.immuni.2021.07.004。
炎症性肠病(Inflammatory bowel disease, IBD)主要包括克罗恩病(Crohn’s disease, CD)和溃疡性结肠炎(Ulcerative colitis, UC),是一组慢性非特异性肠道炎症性疾病。近年来IBD在中国的发病率呈快速增长的趋势,预计到2025年我国IBD患者数目将达到150万以上。目前IBD发病机制尚未完全明确,T细胞功能失衡是IBD重要的致病因素之一。系统地分析健康人、CD和UC患者肠道T细胞的免疫病理特征,揭示CD和UC中T细胞应答模式差异的机制,对于优化IBD精细化、个体化诊疗策略,具有重要的临床意义。
该研究团队利用单细胞转录组测序和代谢组解析了初诊未治疗IBD患者的结肠免疫细胞图谱和代谢微环境特征,发现CD或UC中存在疾病特异性的免疫细胞亚群和代谢物改变,CD患者中存在一群独特的类似1型辅助性T细胞(Th1-like cell)。通过对代谢物的功能筛选,研究发现了可以调控特定疾病中T细胞亚群分化的代谢物,特别是CD患者结肠中特异性减少的含硒代谢物可以调控Th1-like细胞的分化。在T细胞体外分化体系中补充硒可以显著抑制Th1细胞的分化,动物模型研究发现对缺硒的肠炎小鼠补充硒后可显著缓解肠道炎症,减少结肠固有层的Th1细胞。临床研究证实缺硒的CD病人口服补充硒制剂后促进症状的改善及肠道炎症的恢复。进一步的机制研究发现,硒元素主要通过硒蛋白W(Selenoprotein W, SELW)调控一碳代谢和嘌呤补救途径介导活性氧(Reactive Oxygen Species, ROS)清除,从而影响Th1细胞的分化(图1)。
该研究系统解析了初诊CD和UC患者的肠道免疫细胞组成及代谢改变,阐明了代谢物调控特定疾病亚型的免疫机制。补充硒制剂有望通过抑制Th1细胞分化来抑制CD的肠道炎症。该研究成果对于全面理解CD和UC的发病机制差异、开发靶向特定疾病的治疗策略有重要的科学意义和临床价值。






























