一种不影响mRNA分子活性的新型mRNA标记技术
虽然有几种方法可以标记和跟踪活细胞内的RNA,但它们严重倾向于一个令人烦恼的权衡。在一个极端情况下,有些标签会发出强烈的信号,扰乱信使rna的活性。在另一种极端情况下,有些标签能够保持信使rna的天然活性并发出微弱的信号。查尔默斯理工大学的研究人员开发的一种新方法可能解决这个难题。
新方法可用于生成包含tCO三磷酸的mRNA转录本,tCO是一种荧光三环胞嘧啶类似物。这些转录本很容易可视化和追踪。而且,它们的行为就像普通的mRNA转录本,因为荧光胞嘧啶非常像普通胞嘧啶。荧光胞嘧啶,1,3-重氮-2-氧苯恶嗪,可以通过末端标记反应和游离转录酶大量地合并到RNA中。
在最近的一项研究中,Chalmers团队发现,荧光胞嘧啶可以取代1.2 kb长的mRNA中的所有天然胞嘧啶,该mRNA编码组蛋白H2B融合成绿色荧光蛋白(H2B:GFp)。研究人员报告说,这种信使rna在体外和人类细胞中都保留了翻译能力。此外,研究人员证明,他们标记的mRNA具有足够的荧光,可以通过共聚焦显微镜直接在活的人类细胞中观察到。因此,研究人员建议,他们的方法可以用于研究mRNA传递和蛋白质翻译在药物传递的背景下。
详细的研究结果发表在《美国化学学会杂志》一篇名为《Stealth Fluorescence Labeling for Live Microscopy Imaging of mRNA Delivery》的文章中。
“对转录产物的分析表明,tCO实际上与天然CTp一样有效地整合到RNA中,因此在这方面构成了一种真正的模仿自然的荧光修饰,”文章的作者写道。“令人惊讶的是,我们还发现,无论是在体外还是在活细胞中,tco标记的mRNA都被翻译成正确折叠和定位的蛋白质产物。”
他们补充说:“我们展示了第一个荧光碱基类似物标记的核酸的例子,可以直接在活细胞中可视化,表明tCO的亮度和在405 nm处的吸收足以克服FBA探针在生物学应用中的局限性。”“此外,我们展示了这是如何方便地实现在活细胞模型中对化学转染mRNA的摄取、运输和细胞器共定位的时空监测,同时检测其翻译成H2B:GFp蛋白。”
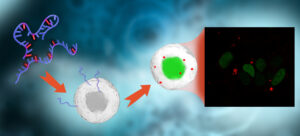
这篇文章的作者强调,他们的方法可以促进新一代核酸药物的新的和改进的递送策略的开发,以及最近成功的mrna疫苗的进一步开发。
基于rna的治疗方法为预防、治疗和潜在治愈疾病提供了一系列新的机会。但目前,RNA疗法进入细胞的效率很低。
Chalmers的Marcus Wilhelmsson博士说:“因为我们的方法可以帮助解决药物发现和开发的最大问题之一,我们看到这项研究可以促进从传统药物到基于rna的治疗的范式转变。”
与信使rna一起工作的一个挑战是,这些分子非常大,带着电荷,但同时又很脆弱。它们不能直接进入细胞,因此必须被打包。迄今为止被证明最成功的方法是使用被称为脂质纳米颗粒的非常小的液滴来封装mRNA。开发新的、更高效的脂质纳米颗粒仍有很大的需求——查尔默斯的研究人员也在致力于此。要做到这一点,就必须了解mRNA是如何被细胞吸收的。因此,实时监测脂质纳米颗粒和mRNA如何在细胞中分布的能力是一个重要的工具。
查尔默斯的Elin Esbj?rner博士,副教授,文章第二主要作者。
Wilhelmsson补充说,到目前为止,还不可能测量RNA在细胞中作用的自然速率和效率。这意味着当你尝试开发一种新药时,你会得到错误的答案。例如,如果你想知道一个过程发生的速率,而你的方法给出的答案是正确速率的五分之一,那么药物发现就变得困难了。”
为了确保该方法的商业化,研究人员已经提交了一份专利申请,并计划在商业孵化器查尔默斯创投(Chalmers Ventures)和查尔默斯创新办公室(Chalmers Innovation Office)的支持下成立一家分拆公司。
“我们相信,”文章的作者总结道,“这里报告的发展将有利于制药行业、临床实验室和学术合作伙伴,旨在进一步了解吸收和内吞体逃逸机制,并允许他们采取重要步骤,以新的和改进的递送策略。”






























