利用酸敏感递药系统协同诱导肿瘤细胞铁死亡与免疫原性死亡
免疫治疗可激活系统性抗肿瘤免疫效应、抑制肿瘤生长、转移和复发,已在临床肿瘤治疗方面表现出巨大潜力。然而,只有一部分癌症患者能从当前的免疫治疗策略中获益,主要是因为肿瘤细胞通常表现出较低的免疫原性,且免疫治疗过程中会引起免疫“负调控”,如免疫检查点(pD-1/pD-L1)上调和去分化程度增强等。这些问题是当前肿瘤免疫治疗面临的巨大挑战。
铁死亡是近年来发现的一种铁依赖的脂质过氧化引起的新型细胞死亡方式。谷胱甘肽过氧化物酶(Glutathione peroxidase 4,GpX4)与胱氨酸(Cystine, Cys)-谷氨酸(Glutamate, Glu)逆向转运体System Xc-是修复过氧化脂质的主要功能蛋白。GpX4和System Xc-失活会导致胞内Glu与胞外Cys的逆向转运阻断,抑制胞内谷胱甘肽合成,进而引起过氧化脂质累积并诱导细胞死亡。同时,铁死亡相关过氧化脂质可作为一种“发现我”的信号,促进树突状细胞对肿瘤抗原的识别、吞噬和处理,并将肿瘤相关抗原呈递给CD8+ T淋巴细胞,进而激活细胞毒性T淋巴细胞,增强肿瘤免疫治疗。
基于上述研究背景,中国科学院上海药物研究所于海军团队提出利用酸敏感递药系统协同诱导肿瘤细胞铁死亡与免疫原性死亡,从而改善抗肿瘤免疫应答的策略。研究人员首先设计合成了偶联光敏剂焦脱镁叶绿酸(ppa)和苯硼酸的两亲性酸敏感高分子嵌段共聚物,通过疏水相互作用和π-π共轭作用包载难溶性的小分子铁死亡诱导剂RSL-3。
研究数据表明,包载RSL-3的纳米粒子可通过EpR效应在肿瘤组织选择性富集,通过施加外部光照可诱导肿瘤细胞免疫原性死亡,启动抗肿瘤免疫应答,诱导细胞毒性T淋巴细胞分泌IFN-γ。更为重要的是,IFN-γ与RSL-3可分别阻断胱氨酸谷氨酸转运受体-谷胱甘肽过氧化物酶(SystemXc--GpX4)介导的过氧化脂质修复通路,增加肿瘤细胞内过氧化脂质累积。由于协同诱导铁死亡,肿瘤组织中去分化肿瘤细胞在治疗后浸润减少了4倍,进一步联合免疫检查点治疗后,细胞毒性T淋巴细胞在肿瘤组织中浸润增加了4倍,有效抑制了肿瘤的生长和转移,提高了荷瘤小鼠的生存率。这种基于肿瘤细胞铁死亡的免疫疗效策略有望为改善铁死亡介导肿瘤免疫治疗提供新思路。
相关研究成果于2021年6月25日发表于Advanced Materials,上海药物所硕士研究生宋润迪、博士后李天亮为共同第一作者,于海军研究员为本文通讯作者。该研究获得了国家自然科学基金、上海科委国际合作交流项目、国家博士后基金和上海市超级博士后项目的资助。
全文链接:https://onlinelibrary.wiley.com/doi/epdf/10.1002/adma.202101155
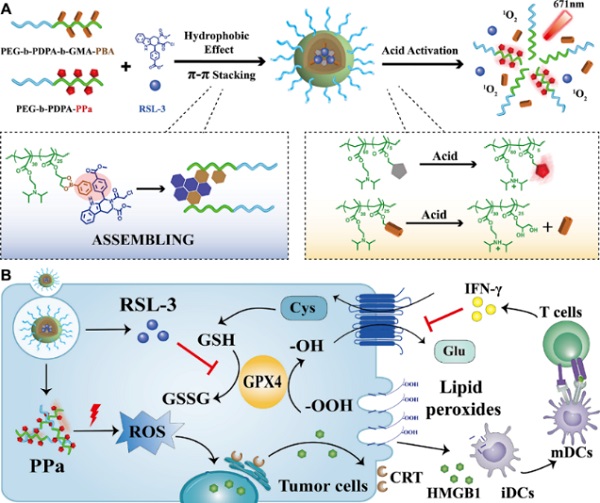
图1. 酸激活纳米粒用于诱导肿瘤细胞铁死亡与增强抗肿瘤免疫治疗原理图。
(供稿部门:于海军课题组;供稿人:李天亮)






























