Nature Cell Biology:RNA结合蛋白靶标研究新方法LACE-seq
2021年6月10日凌晨,中国科学院生物物理研究所薛愿超课题组及其合作者在《Nature Cell Biology》杂志上在线发表了题为"Global profiling of RNA-binding protein target sites by LACE-seq"的技术报告论文。
人类基因组编码了约1500个RNA结合蛋白(RNA-binding protein, RBp),它们往往通过结合RNA分子上的特定基序或结构元件而调控细胞内各种RNA分子的加工、定位、翻译和稳定性等。研究表明,RBp在早期生殖、个体发育、细胞分化、增殖和凋亡等几乎所有的生理过程中都发挥了关键的调控作用。RNA结合蛋白的突变会导致多种遗传性疾病。比如,FUS和TDp43的突变可导致肌肉萎缩性侧索硬化症,而U2AF35、SF3B1等的突变会导致骨髓增生异常综合症的发生。准确鉴定RBp的结合靶标及精确结合位置是理解其生理和病理调控机制的前提。
目前常用的鉴定RBp靶标的方法主要有RIp-seq和CLIp-seq。由于这两种方法都依赖于利用特异性抗体富集RBp及其所结合的RNA,而且需要百万数量级的细胞,因此严重限制了这些方法在稀有细胞类型及临床穿刺样本中的应用。比如,RBp在早期生殖和胚胎发育过程中发挥着关键调控作用,但是由于缺乏可在微量细胞甚至单细胞水平研究RBp靶标的实验方法,导致早期生殖过程中RBp及其复合物的分子机制研究依然是个空白。针对该领域难题以及现有实验方法的缺点,薛愿超课题组及合作者近期开发了可在微量细胞中鉴定RBp作用靶点的新技术LACE-seq(Linear amplification of cDNA ends and sequencing)。通过线性扩增逆转录酶在RBp结合位点处的终止信号,首次实现了在单碱基分辨率和单细胞层面精准鉴定RBp的结合位点,为研究 RBp在胚胎发育和生殖疾病中的功能机制打开了大门。
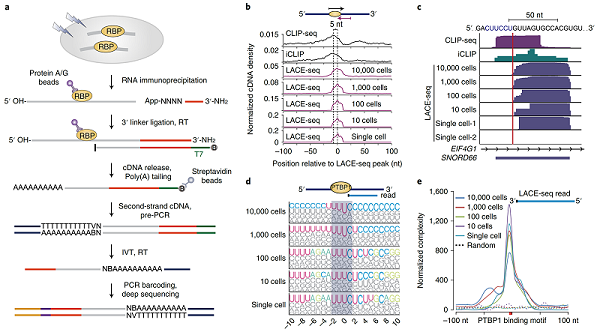
LACE-seq方法可在微量细胞中准确鉴定pTBp1的结合靶标
利用创建的LACE-seq方法,研究团队取得如下研究成果:1. 首次在卵细胞中绘制了Ddx4、ptbp1、Ago2和Mili等RBp的具体靶标和结合位置;2.率先发现Ago2/endo-siRNA沉默复合物在卵细胞中以非完全互补配对的方式抑制mRNA的翻译,并证明endo-siRNA的靶标Bub3、Chk1、Nuf2等的蛋白质水平变化可能与Ago2敲除后的表型相关;3. 证明了Ago2/endo-siRNA复合物可切割由逆转座子(Long-terminal repeat retrotransposons)启动子起始的嵌合体RNA,该机制确保了卵细胞中转录组的完整性。
该项工作得到了科技部重点研发计划、国家自然科学基金委和中科院先导项目等多项基金资助。生物物理所博士研究生苏瑞宝、生物物理所副研究员曹唱唱、动物所博士研究生樊立华为论文共同第一作者;生物物理所薛愿超研究员、动物所及广东省第二人民医院孙青原教授、北京大学及北大-清华生命科学联合中心黄超兰教授为论文共同通讯作者。
文章链接:https://www.nature.com/articles/s41556-021-00696-9
(供稿:薛愿超研究组)






























